Урок 29. Галогены Cl2 и HCl (часть 1)
Химия. Онлайн учебник → Галогены Cl2 и HCl (часть 1)
http://slideplayer.com/slide/6019462/
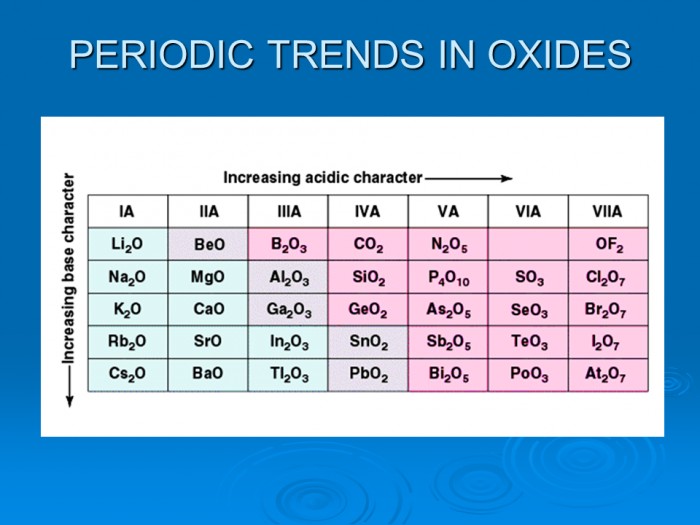
Главную подгруппу VIII группы периодической системы создают p-элементы - галогены: Фтор, Хлор, Бром, Йод, Астат. Кроме Астата, все они встречаются в природе. Окислительная способность уменьшается в ряде галогенов от Фтора к Йоду: F > Cl > Br > I, а восстановительные способности увеличиваются.
Химические формулы
F2 - фтор, неполярная ковалентная связь.
Cl2 - хлор, Br - бром, I - йод.
F2, Cl2 - газы, Br2 - жидкость, I2 - кристаллы.
Реакции свойственные для Cl2
1. Взаимодействие с металлами:
Na + Cl2 = 2NaCl - хлорид натрия.
2. Взаимодействие с неметаллами:
Cl2 + 2S = S2Cl2 - хлорид сульфура
I2 + 3Cl2 =2ICl3 - хлорид йода.
3. Взаимодействие с водой (создаются две кислоты):
Cl2 + H2O = HCl + HClO
HCl - соляная кислота, HClO - хлористая кислота
Хлор одновременно является окислителем и восстановителем.
Хлорид Водорода (HCl), или хлороводород, является одним из наиболее важных неорганических соединений. Он служит реагентом в разных процессах в химической технологии. Водный раствор хлороводорода - широко используют в промышленности, химических лабораториях.
Графическая формула H--Cl, связь ковалентная полярная H(5+) → Cl(5-).
HCl - хлороводород - бесцветный газ с резким запахом тяжелее воздуха, хорошо растворяется в воде, сильно раздражает дыхательные пути.
Хлорная кислота - HCl - сильная кислота. a(HCl) превышает 90%. Тривиальное название - соляная кислота.
Химические свойства HCl
1. Взаимодействие с металлами (металлы, размещенные в ряде активности справа от водорода, с HCl не взаимодействуют):
Zn + 2HCl = ZnCl2 + H2
2. Взаимодействие с основными и амфотерными оксидами:
MgO + 2HCl = MgCl2 + H2O
ZnO + 2HCl = ZnCl2 + H2O
3. Взаимодействие с основными и амфотерными гидроксидами:
NaOH + HCl = NaCl + H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
4. Взаимодействие с большинством солей:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
Pb(NO3)2 + 2HCl = PbCl2 + 2HNO3
Галогены (часть 1) (часть 2)
Автор: Гончаренко Л. И. (ula-books.com.ua)
< Урок 28 | Химия. Онлайн учебник | Урок 30 >
Смотрите также:
Свойства и связь кристаллических решеток
Урок 19. Химические свойства металлов
Урок 18. Металлические элементы