Урок 49. Бензол. Строение бензольного ядра
Химия. Онлайн учебник → Бензол. Строение бензольного ядра
| Общая формула: CnH2n+6 |
| Валентный угол: 120° |
| Тип гибридизации атомных орбиталей атомов Углерода: sp2 |
| Химическая связь: ароматическая - соединение сигма- и пи-связей |
| Длина связи: C--C составляет 140 нм |
| Энергия связи: C--C составляет 412 кДж/моль |
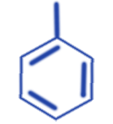
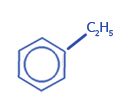
| Номенклатура: тривиальная (толуол, ксилол, кумол); международная - гомологи бензола рассматривают как замещенные исходящие бензола (метилбензол, этилбензол и т.д.) |
|
Общее название ароматических радикалов - арил. Например - фенил:
|
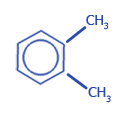
Изомерия гомологов бензола обусловлена изомерией радикалов, их количеством и положением в бензольном ядре:
|
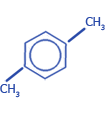
этилбензол |
1,2-диметилбензол (o-ксилол) |
|
1,4-диметилбензол (n-ксилол) |
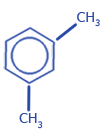
1,3-диметилбензол (m-ксилол) |
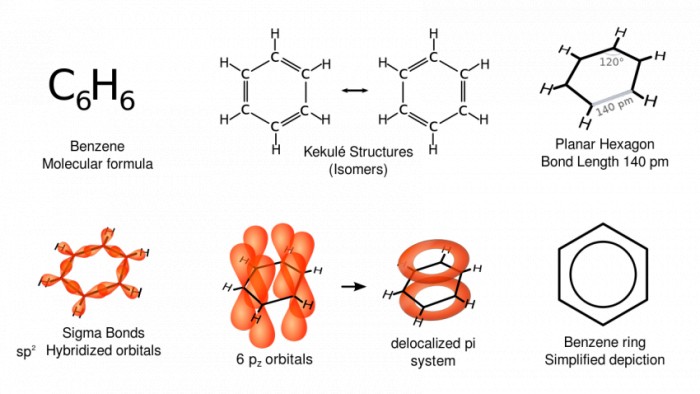
Особенности строения бензольного ядра и молекулы бензола
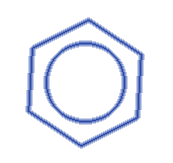
Молекула бензола - плоский шестичленный цикл, в котором все шесть атомов Углерода и шесть атомов Водорода размещены в одной плоскости и создают правильный шестигранник с углом 120°.
Молекула бензола симметричная и неполярная, в ней отсутствуют одинарные и двойные связи, все шесть C--C связей являются сигма-связями с одинаковой длиной связи.
Молекула бензола имеет делокализованную систему пи-электронов (секстет) в ароматическом ядре. Она является основной приметой ароматичности органического соединения. Стойкость бензольного кольца объясняется сопряжением всех шести p-электронов.
Химические свойства бензола
|
Бензол, бензольное ядро стойкое к окислителям. На воздухе горит коптящим пламенем. В кислороде сгорает до CO2 и H2O: C6H6 + 7,5O2 → 6CO2 + 3H2O
|
|
| Реакции замещения | |
|
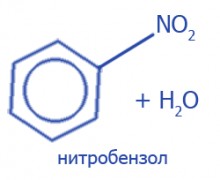
+HNO3 (конц.), H2NO4 (конц.) → Нитрование |
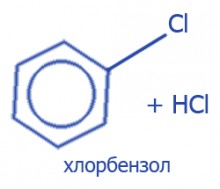
+Cl2, AlCl3 → Галогенирование |
| Реакции соединения (присоединения) | |
|
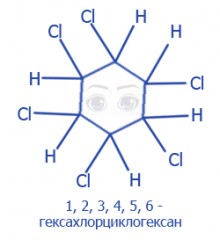
+3Cl2(Br2), h v → |
3H2, Pt → |
Нитрование - реакция замещения атома Водорода на нитрогруппу NO2. Нитрогруппа - часть молекулы нитратной кислоты HNO3, формулу которой можно записать как: HO--NO2.
Получение бензола в промышленности
1. Каталитическая дегидратация гексана:
C6H14 (t.k) → C6H6 + 4H2
2. Каталитическая дегидратация циклопентана:
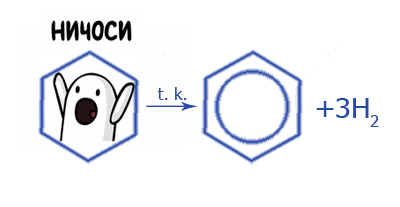
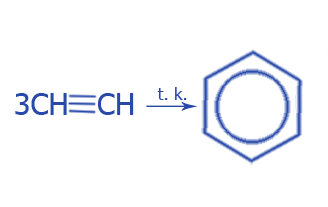
3. Тримеризация ацетилена:
Автор: Гончаренко Л. И. (ula-books.com.ua)
< Урок 48 | Химия. Онлайн учебник | Урок 50 >
Смотрите также:
Урок 69. Амины. Анилин (часть 2)
Задачи 5-8: Объем и плотность газа
Задачи. Вещество и молярная масса