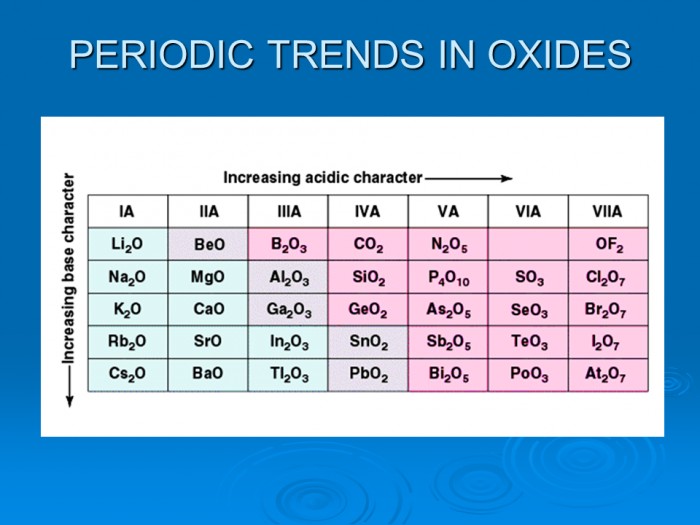
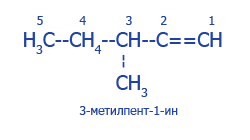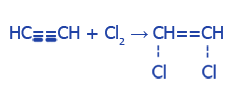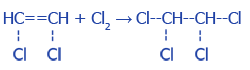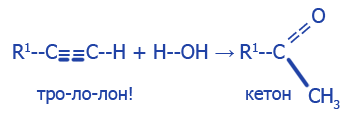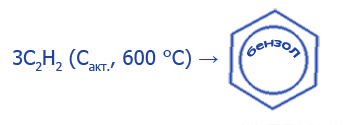Урок 48. Алкины. Применение ацетилена
Химия. Онлайн учебник → Алкины. Применение ацетилена
| Общая формула: CnH2n-2 |
| Валентный угол: 180° |
| Тип гибридизации атомных орбиталей атома Углерода, соединенных тройной связью: sp |
| Химические связи: наличие одной сигма-связи и двух пи-связей |
| Длина связей: C=C составляет 0,120 нм |
| Энергия связей: C=C составляет 812 кДж/моль |
| Номенклатура: название соответствующего алкана с заменой суффикса -ан на -ин. Исключение: пропин. |
Вид изомерии
| Структурная | |
| Распределение углеродного скелета |
CH3--CH2--CH2--CH2--C=CH - гекс-1-ин
|
| Положение тройной связи |
CH=C-CH2-CH3 - бут-1-ин H3C-C=C-CH3 - бут-2-ин |
| Межклассовая | |
|
Алкины изомерные алкадиенам: CH3--CH2--C=CH - бут-1-ин CH2=CH--CH=CH2 - бута-1,3-диен |
|
Получение алкинов
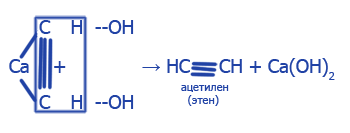
1. Карбидный метод: CaCO3 (t, -CO2) → CaO (+3C, 300 °C) → CaC2 + CO
2. С метана:
а) пиролиз: 2CH4 (1500 °C) → C2H2 + 3H2;
б) окислительный пиролиз метана: 6CH4 + O2 (1500 °C) → 2C2H2 + 2CO + 10H2;
3. Взаимодействие дигалогеналкинов соответствующего строения со спиртовым раствором щелочи:
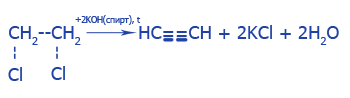
Химические свойства алкинов
| Реакции соединения (присоединения к H--C=C--H) | |
|
водорода (kt - Pt, t): HC=CH + H2 → CH2=CH2 CH2=CH2 + H2 → CH3--CH3 |
Гидрирование (гидрогенизация) |
|
галогенов (Br2, Cl2):
|
Галогенирование |
|
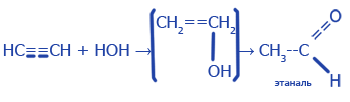
воды (Hg2+, H+):
|
Гидратация (реакция Кучерова). Происходит по правилу Марковникова |
| Замещение H возле тройной связи R--C=C--H ⇔R--C=C---H+ |
|
с активными металлами (создаются подобные соли металлические исходящие ацетиленов): 2CH3--C=C--H + 2Na → 2CH3--C=C--Na + H2 2CH3--C=C--Na - ацетиленид натрия |
|
с солями Меди (I) (красно-коричневый осадок ацетиленида меди (I)): HC=CH + 2[Cu(NH3)2]OH → Cu--C=C--Cu + 4NH3 + 2H2O Cu--C=C--Cu + 4NH3 - красно-коричневый осадок |
|
с солями серебра (белый осадок ацетиленида серебра): HC=CH + 2[Ag(NH3)2]OH → Ag--C=C--Ag + 4NH3 + 2H2O Ag--C=C--Ag - белый осадок |
| Полимеризация | |
|
циклическая:
|
Тримеризация |
|
линейная: 2HC=CH (CuCl, NH4Cl, HCl) → H2C=CH--C=C--H |
Димеризация |
| Окисление |
|
полное окисление (горение) (горит на воздухе, непостоянным пламенем): 2C2H2 + 5O2 → 4CO2 + 2H2O |
|
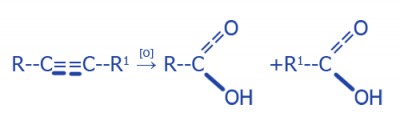
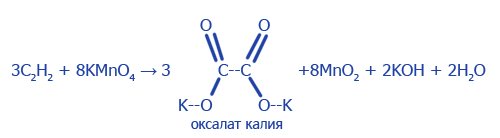
частичное окисление (водяной раствор KMnO4, медленно теряет цвет):
|
|
окисление сильными окислителями в кислой среде (окислители: KMnO4, K2Cr2O7 - в кислой среде, озон): |
Качественные реакции на ацетилен (этин)
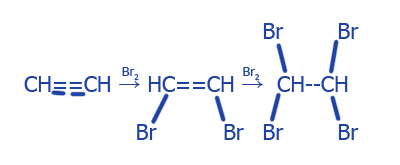
1. Взаимодействие с бромной водой (бромная вода теряет цвет):
2. Взаимодействие с аммиачным раствором оксидом серебра (I):
CH=CH + Ag2O (NH3, -H2O) → Ag--C=C--Ag
Ag--C=C--Ag - белый
3. Взаимодействие с водяным раствором перманганата калия (раствор теряет цвет):
Алкины обнаруживают при помощи бромной воды (потеря цвета раствором) и аммиачного раствора оксида серебра (I) (создается белый осадок).
Ацетилен применяют
1. В производстве каучуков.
2. В производстве синтетических волокон.
3. В производстве уксусной кислоты.
4. В производстве растворителей.
5. Во время сварки и резки металлов.
6. Во время получения винилхлорида:
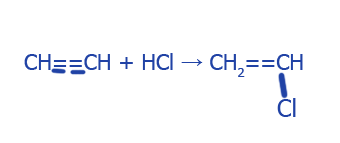
и поливинилхлорида:
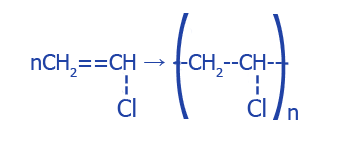
7. Во время получения уксусного альдегида (ацетальдегида):
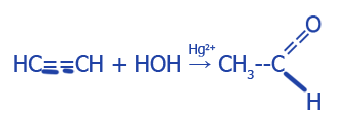
Автор: Гончаренко Л. И. (ula-books.com.ua)
< Урок 47 | Химия. Онлайн учебник | Урок 49 >
Смотрите также:
Двухатомные спирты. Этиленгликоль
Классификация химических реакций в орг. химии
Влияние атомов в молекулах органических соединений