Урок 7. Периодический закон и периоды
Химия. Онлайн учебник → Периодический закон и периоды
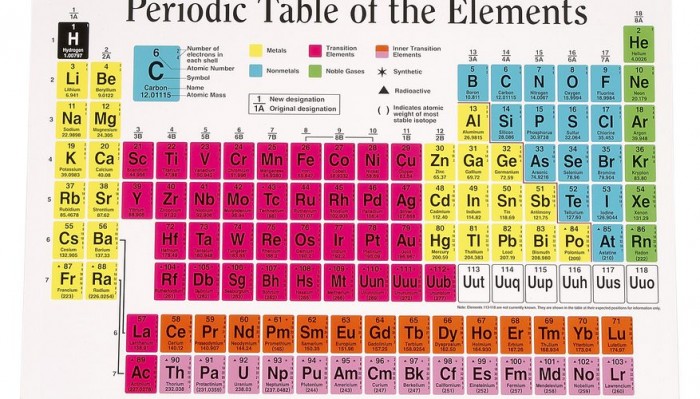
Изображение: bizfluent.com.
Современная формулировка периодического закона: свойства химических элементов, простых веществ, а также состав и свойства соединений пребывают в периодической зависимости от значений зарядов ядер атомов.
Периодическая система имеет форму таблицы. существуют короткий и длинный варианты системы. Чаще используют короткий вариант, из-за его удобности и компактности.
Составляющие периодической системы: семь периодов и восемь групп.
Период - горизонтальный ряд химических элементов, расположенный в порядке увеличения зарядов ядер их атомов, начинается с щелочных металлов и заканчивается инертными газами (первый период начинает Водород)
Периоды
|
малые 1, 2, 3 периоды включают элементы только главных подгрупп |
большие 4, 5, 6, 7 периоды включают элементы как главных, так и побочных подгрупп |
Периоды нумеруют арабскими цифрами.
Группа - столбик элементов в коротком варианте периодической системы или два столбика в длинном варианте. Периодическая система состоит из восьми групп элементов. Их принято нумеровать римскими цифрами. Каждая группа состоит из двух подгрупп - главной и побочной. Главные группы обозначены буквой а в периодической системе, побочные - буквой b.
По электронному строению атомов различают s-, p-, d- и f-элементы.
Номер периода, в котором размещен элемент, указывает количество энергетических уровней в его атоме, а номер группы - количество электронов на внешнем уровне и максимальное значение валентности.
Радиусы атомов элементов в периоде уменьшаются слева-направо, а в группе (подгруппе) увеличиваются сверху-вниз.
Щелочные металлы. I группа, главная подгруппа, типичные металлы.
Температура кипения и плавления
<-------------------------------------------------
Li Na K Rb Cs Fr
------------------------------------------------->
Увеличиваются радиус атома, густота, электроотрицательность, электропроводность, химическая активность
С водой создают щелочь - растворенные основы с общей формулой M(OH), где M - металл.
Щелочноземельные металлы составляют главную подгруппу II группы (Mg, Ca, Sr, Ba, Ra) - сильные восстановители, но слабее чем щелочные. водой создают щелочи - M(OH)2; Mg(OH)2 к щелочи не относится.
Инертные газы (благородные) входят в главную подгруппу VIII группы (He, Ne, Ar, Kr, Xe, Rn) - неметаллы. Состоят из атомов.
Галогены - неметаллы главной подгруппы VII группы (F, Cl, Br, I). Неметаллические свойства наиболее сильные у F. Реакционная способность галогенов ослабляется в ряде F---Cl---Br---I. Поэтому предыдущий элемент способен вытеснять следующий среди кислот типа НГ (Г - галоген) и их солей.
Закономерно изменяются физические свойства галогенов с увеличением порядкового номера: фтор - газ, что тяжело разряжается, хлорка - газ, что легко разряжается, бром - жидкость, йод - твердое вещество.
Автор: Гончаренко Л. И. (ula-books.com.ua)
Смотрите также:
Производство чугуна и стали
Урок 22. Натрий (Na) и Калий (K)
Способы получения металлов