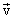Урок 6. Гомогенные и гетерогенные реакции. Скорость
Химия. Онлайн учебник → Гомогенные и гетерогенные реакции. Скорость
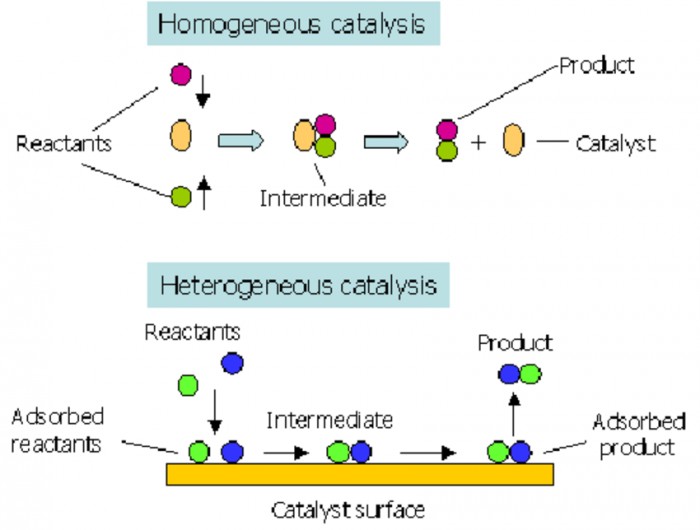
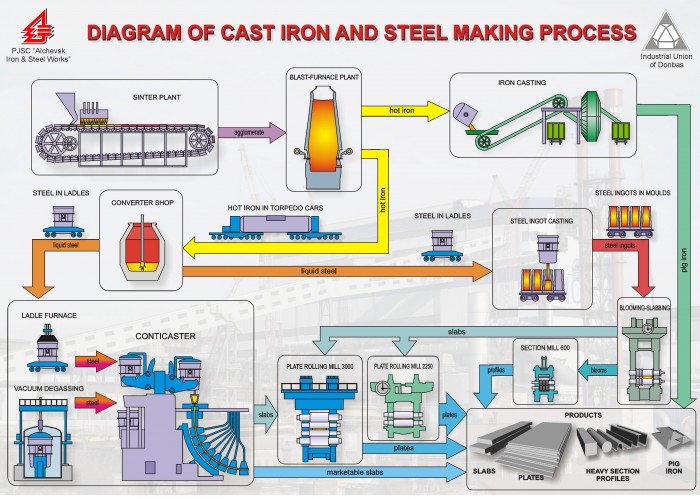
Изображение: www.researchgate.net.
Скорость химической реакции определяется изменением концентрации реагирующих веществ (или продуктов реакции) за единицу времени. Реакции в однородной среде называют гомогенными, а в неоднородной (между газом и твердым телом) - гетерогенными.
Скорость гомогенной реакции определяется количеством вещества, которое вступило в реакцию или появилось в результате реакции за единицу времени в единице объема:
vгомог.= + или - Δv / V x Δt
Δv=v1-v2 - изменение количества вещества, V - объем системы (раствора, смеси реагирующих веществ), Δt - интервал времени. Единица измерения - моль/л • с или моль/м3 • с.
Скорость гетерогенной реакции определяется количеством вещества, которое вступило в реакцию или создалось в результате реакции за единицу времени на единице поверхности разделения фаз:
vгетер.= + или - Δv/S•Δt
S - площадь разделения фаз.
Скорость химической реакции зависит от различных факторов:
1) для веществ в жидкой и газовой фазах v реакции зависит от концентрации веществ вступивших в реакцию. Например, окисления оксида азота (II) чистым кислородом происходит быстрее, чем реакция окисления кислородом воздуха:
2NO+O2=2NO2
2NO, O2 - бесцветные газы, 2NO2 - коричневый газ.
2) реакции в твердой фазе происходят быстр, если вещества вступившие в реакцию пребывают в порошко-подобном состоянии. Так сахар горит только в пламени, а сахарная пудра вспыхивает от искры;
3) от температуры: с повышением ее на 10 °С v реакции увеличивается в 2-4 раза;
4) на v реакции влияют катализаторы:
N2+3H2(к)=2NH3;
Автор: Гончаренко Л. И. (ula-books.com.ua)
Химические реакции: (часть 1) (часть 2) (часть 3)
< Урок 5 | Химия. Онлайн учебник | Урок 7 >
Смотрите также:
Хлороводород и хлорная кислота
Урок 28. Электролиз раствора CuCl2
Электролиз раствора KCl и K2SO4