Урок 4. Типы химических реакций
Химия. Онлайн учебник → Типы химических реакций
Изображение: https://wikimedia.org.
Пример схемы реакции с дополнительными обозначениями и названием веществ:
CaCO3 (t) → CaO + CO2;
CaCO3 - мел, CaO - негашенная известь, CO2 - углекислый газ;
Пример комментирования: во время нагрева мела создается негашенная известь и углекислый газ. Схема реакции дает возможность сделать вывод: все атомы химических элементов во время реакции сохраняются.
Закон сохранения массы веществ
М. В. Ломоносов и А. Л. Лавуазье открыли закон сохранения массы веществ во время химической реакции: масса веществ, которые вступили в химическую реакцию, равна массе веществ, которые появились в результате реакции.
Химическое уравнение - запись химической реакции при помощи формул реагентов и продуктов, который отвечает закону сохранения массы веществ:
C + O2 (t) = CO2
2Al + 6HCl = 2ALCl3 + 3H2
MgCO3 (t) = MgO + CO2
Типы химических реакций
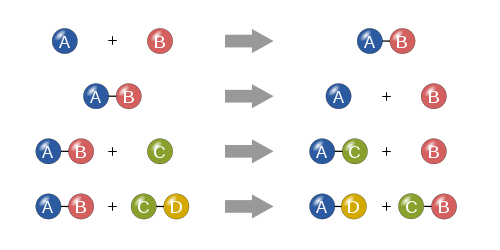
1. По количеству реагентов и продуктов:
- Соединения: 2H2+O2=2H2O (с двух или больше веществ создается одно новое вещество)
- Распада: 2HgO=2Hg+O2 (из одного вещества создаются два или больше новых веществ)
- Обмена: HCl+NaOH=NaCl+H2O (два вещества обмениваются своими составляющими частями - создаются два новых вещества)
- Замещения: Zn+2HCl=ZnCl4+H2 (реакции между простым и сложным веществами, во время которых атомы простого вещества замещают атомы одного из элементов сложного вещества, при этом создавая новые вещества - одно простое и одно сложное)
2. По изменению степени окисления продуктов:
- Окислительно-восстановительные: 2KI+Cl2=2KCl+I2 (происходят с изменением степени окисления элементов реагирующих веществ)
- Не окислительно-восстановительные: 2HCl+Ca(OH)2=CaCl2+2H2O; CaO+CO2=CaCO3 (протекает без изменения степени окисления элементов реагирующих веществ: реакции обмена, большинство реакций соединения и распада)
3. По тепловому эффекту:
- Экзотермические: C+O2(t)=CO2+393,5 кДж или ΔH=-395,5 кДж (происходят выделением тепла (ΔH>0, Q<0))
- Эндотермические: CaCO3(t)=CaO+CO2-180 кДж или ΔH=180 кДж (происходят с поглощением тепла (ΔH>0, Q<0))
4. По направлению течения:
- Обратимые: 3H2+N2(t)⇔2NH3; CO2+Cl2⇔COCl2 (проходят в двух противоположных направлениях одновременно при одинаковых условиях)
- Необратимые: HCl+KOH=KCL+H2O; NaCl+AgNO3=AgCl+NaNO3 (проходят только в одном направлении)
Автор: Гончаренко Л. И. (ula-books.com.ua)
Химические реакции: (часть 1) (часть 2) (часть 3)
< Урок 3 | Химия. Онлайн учебник | Урок 5 >
Смотрите также:
Относительная атомная и молекулярная масса
Бинарные и многоэлементные соединения
Чистые вещества и смеси в химии