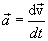Урок 3. Относительная атомная и молекулярная масса
Химия. Онлайн учебник → Относительная атомная и молекулярная масса

Изображение: www.youtube.com.
Относительная атомная масса (Ar) — физическая величина, которая определяется отношением массы атома элемента к 1/12 части массы атома Карбона:
m(F) = 3,15481 x 10-23 г;
ma(C12) = 2 x 10-26 г;
1/12=ma(C12) = 1,6605 x 10-27 г;
Ar(F)=3,15481x10-23 г/1,6605x10-24=18,9984=19.
Относительная молекулярная масса вещества (Mr) — физическая величина, которая равняется отношению массы молекулы вещества к 1/12 частицы массы атома Карбона:
Mr(молекулы)=m(молекулы) / 1/12ma(C12);
Относительная молекулярная (по формуле) масса Mr равняется сумме относительных масс атомов элементов Ar, которые входят в состав молекулы или единицы формулы, учитывая число атомов элементов:
Mr(X) = nAr(E1) + nAr(E2)+ nAr(E3)
(X) — химическое вещество, n – число атомов химических элементов; E1, E2, E3 – химические элементы.
Пример: Mr(Al2O3) = 2Ar(Al) + 3Ar(O) = 2 X 27 + 3 X 16 = 54 + 48 = 102.
Массовая часть элемента (w) — отношение массы элемента к общей массе молекулы:
w(E) = m(E) / m(соединения) или w(E) = Ar(E) x n(E) / Mr(x)
Ar(E) — относительная атомная масса элемента, n(E) — количество атомов элемента в этом веществе, Mr(x) — относительная молекулярная масса вещества x. Величина w — безразмерная, потому ее часто отображают в процентах:
w(E) =( m(E) / m(соединения) ) x 100 проц.
Молярная масса вещества (M) — физическая величина, которая равняется отношению массы вещества (m), к соответствующему количеству вещества (v):
M = m/v;
Молярная масса — 1 моль вещества.
M(C) = 12г/моль; M(O2) = 16 x 2 = 32г/моль
Молярный обьем (Vм) – обьем 1 моль вещества:
m = p x V,
M = p x Vm;
Vm = M / p
m – масса вещества; p – густота вещества; V – объем вещества.
Ученые установили, что Vm разных газов при одинаковых условиях составляет 22,4л/моль. Нормальные условия (н.у.): 0 градусов C, 101,3 кПа, или 760 мм рт. ст. или 1 атм. 1 моль любого газа при нормальных условиях занимает объем 22,4л. Для газов при н.у. Vm = 22,4л/моль.
Молярный обьем — отношение объема к количеству вещества:
Vm = V / v;
v – количество вещества, V – объем вещества.
Закон Авогадро. В одинаковых объемах различных газов при одинаковых температуре и давлении содержится одинаковое количество молекул. Следствие закона Авогадро: в одинаковых объемах различных газов при одинаковых температуре и давлении содержится одинаковое количество вещества:
Na = 6,02 x 1023 / 1 моль = 6,02 x 1023 моль-1;
Na – число Авогадро (постоянная Авогадро).
Средняя относительная молекулярная масса воздуха равна 29.
В 1811 г. италийский физик Амедео Авогадро сформулировал закон, который вводил в науку представления об молекулах как наименьших частицах вещества. Ученый особенно подчеркивал, что молекулы простых веществ совсем не должны по количеству быть равными с атомами, наоборот, они обычно состоят из нескольких одинаковых атомов. Закон Авогадро дал возможность сделать выводы о числе атомов в молекулах газов.
Относительная густота газа (D) — отношение массы одного газа к массе другого газа такого самого объема (безразмерно):
DH2(O2) = Mr (O2) / Mr (H2),
DH2(O2) = 16.
Относительная густота газа B по воздуху:
Dвоз.(B) = Mr(B) / 29.
Автор: Гончаренко Л. И. (ula-books.com.ua)
Основы химии: (вещество) (валентность) (атомная масса)
< Урок 2 | Химия. Онлайн учебник | Урок 4 >
Смотрите также:
Строение энергетических уровней атома
Онлайн тесты по химии (с ответами)
Основные типы химической связи