Урок 8. Строение энергетических уровней атома
Химия. Онлайн учебник → Строение энергетических уровней атома
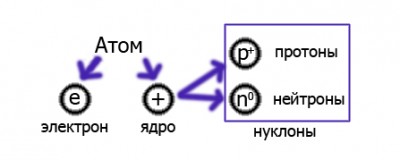
Протонное число - количество протонов в атоме. Нуклонное число - суммарное количество протонов и нейтронов в атоме.

N(p+)=N(e)=Z
N(p+) - количество протонов, N(e) - количество электронов, Z - порядковый номер элемента.
N(n0) = A - N(p+) = A - N(e) = A - Z
N(n0) - количество нейтронов, A - нуклонное число, Z - порядковый номер элемента.
N(n0) = Ar - Z
Ar - относительная атомная масс.
Простые ионы элементов содержат столько p+ и n0, сколько и атомы, но отличаются от них по количеству электронов. в F- содержится на 1е больше, чем в атоме F, а в Be2+ - на 2е меньше, чем в атоме Be.
Виды атомов одного элемента с разным количеством нейтронов называют изотопами, а какой-либо вид атомов - нуклидом. Изотопы - это нуклиды одного элемента.
Часть пространства в атоме, где пребывание электрона наиболее вероятно, называют орбиталью.
Упрощенное изображение орбитали  , а е в ней обозначают стрелкой:
, а е в ней обозначают стрелкой: 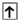 . Если
. Если 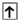 , то е называют неспаренным, а если
, то е называют неспаренным, а если 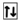 - спаренным. Эти два электрона отличаются между собой по примете, называющейся спином.
- спаренным. Эти два электрона отличаются между собой по примете, называющейся спином.
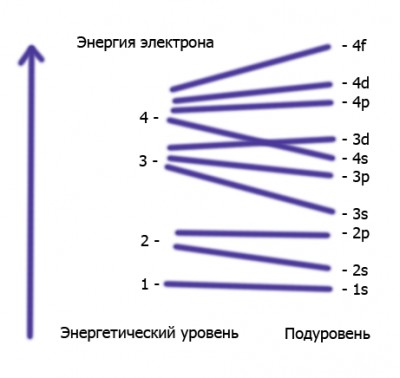
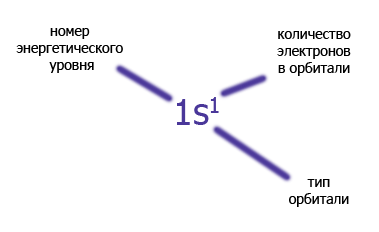
По энергии электроны распределяются по энергетических уровнях, состоящих из подуровней, причем номер уровня указывает на количество подуровней.
Максимальное количество электронов на энергетическом уровне:
Nmax(e)=2n2
n - номер уровня.
Количество орбиталей на энергетическом уровне:
Nорб.=n2
Типы орбиталей
Заполнение электронами энергетических уровней и подуровней в атомах разных элементов:
| эл. | элек. формула | граф. формула | эл. | элек. формула | граф. формула |
| 1H | 1s1 | 1s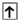 |
6C | 1s22s22p3 | 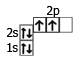 |
| 2He | 1s2 | 1s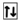 |
7N | 1s22s22p3 | 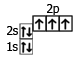 |
| 3Li | 1s22s1 | 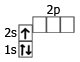 |
8O | 1s22s22p4 | 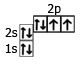 |
| 4Be | 1s22s2 | 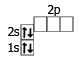 |
9F | 1s22s22p5 | 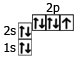 |
| 5B | 1s22s22p1 | 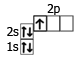 |
10Ne | 1s22s22p6 | 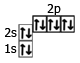 |
Процесс перехода электрона с одной орбитали к другой в пределах энергетического уровня называют возбуждением атома. (* - обозначение возбужденного состояния атома).
C → C*
1s22s22p2 → 1s22s12p3
 |
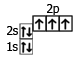 |
На каждом энергетическом уровне электроны сначала заполняют s-орбитали, затем - p-орбитали. Количество неспаренных электронов в атоме указывает на возможное значение валентности элемента.
Атом при наличии свободных орбиталей на последнем энергетическом уровне может переходить в возбужденное состояние. При этом за счет разрыва электронных пар количество неспаренных электронов в атоме увеличивается и возникает возможность увеличения элементом своей валентности.
Автор: Гончаренко Л. И. (ula-books.com.ua)
Смотрите также:
Алюминий. Хим. взаимодействие
Тривиальные названия кислот
Магний (Mg) и Кальций (Ca)