Урок 23. Магний (Mg) и Кальций (Ca). Электронное строение атомов
Химия. Онлайн учебник → Магний и Кальций. Электронное строение атомов

Twitter: Brian Greene
MgCO3 - магнезит.
KCl x MgCl2 x 6H2O - карналлит.
MgCO3 x CaCO3 - доломит.
CaCO3 - мел, мрамор.
CaSO4 x 2H2O - гипс.
CaF2 - флюорит.
Ca5(PO4)3F - фторапатит.
В природной воде присутствуют Ca2+ и Mg2+.
Электронное строение атомов и ионов Кальция и Магния
Mg(0) - 2e = Mg(+2)
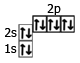
1s22s22p63s2 1s22s22p6
3s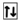
 -2e →
-2e → 
Ca(0) - 2e = Ca(+2)
20Ca 1s22s22p63s23p64s2 1s22s22p63s22p6
4s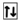
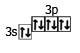
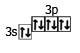
 -1e →
-1e → 
Mg и Ca - серебристо-белые летучие металлы, тяжелее чем щелочные, их tпл. выше. Активность Mg и Ca - высокая, но она меньше, чем у щелочных металлов.
Химические свойства Кальция и Магния
1. Взаимодействие с кислородом:
2Ca + O2 = 2CaO - оксид кальция
2. Медленно вступают в реакцию с водой:
Ca - обычные условия
Ca + 2H2O = Ca(OH)2 + H2
Mg - только во время нагрева
3. Взаимодействие с кислотами:
а) с соляной HCl и разбавленной серной создается водород:
Mg + 2HCl = MgCl2 + H2
б) с азотной - продукты восстановления Азота:
4Mg(0) + 10HNO3(+5) (конц.) = 4Mg(+2)(NO3)2 + N2O(+1) + 5H2O
Mg(0) - 2e → Mg(+2) | 4
2N(+5) + 8e → 2N(+1) | 1
в) с серной - продукты восстановления Серы:
Mg(0) + 2H2SO4(+6) (конц.) = Mg(+2)SO4 + SO2(+4) + 2H2O
Mg - 2e → Mg(+2) | 1
S(+6) + 2e → S(+4) | 1
4. Взаимодействие с растворами солей, вытеснение менее активных металлов:
Mg + CuSO4 = MgSO4 + Cu
Ca - вступает в реакцию с водой
Оксиды Магния и Кальция - MgO и CaO - белые тугоплавкие вещества, основные оксиды.
Химические свойства CaO
| + H2O | + кислоты | + кислотный оксид | + амфотерный гидроксид |
| CaO + H2O = Ca(OH)2 | CaO + H2SO4 = CaSO4 + H2O | CaO + N2O5 → Ca(NO3)2 | CaO + Zn(OH)2 = CaZnO2 + H2O |
Гидроксиды Магния и Кальция - Mg(OH)2 и Ca(OH)2 - белые порошки, малорастворимые в воде.
Суспензия Ca(OH)2 - известковое молоко, а водный раствор Ca(OH)2 - известковая вода. Ca(OH)2 - гашеная известь, используется в строительстве, хлорная известь - дезинфицирующее средство.
2CaSO4 x H2O - алебастр. MgSO4 x 7H2O - горькая соль (лекарства). Водная суспензия Mg(OH)2 - лекарственное средство.
Кислые ортофосфаты Кальция используют в качестве фосфорных удобрений:
Ca(H2PO4)2 x H2O и CaSO4 х 2H2O - простой суперфосфат.
Ca(H2PO4)2 х H2O - двойной суперфосфат.
CaHPO4 х 2H2O - преципитат.
Ca3(PO4)2 - фосфоритная мука.
Ионы Ca2+ и Mg2+ обуславливают жесткость.
Жесткость воды и методы ее устранения
|
Временная, или карбонатная (Ca2+, Mg2+, HCO3-) |
Постоянная, или не карбонатная (Ca2+, Mg2+, SO42-, Cl-) |
|
1. Во время кипячения воды Ca(HCO3)2 (t) = CaCO3 + CO2 + H2O 2. Добавление кальцинированной соды Na2CO3, или извести Ca(OH)2 Ca(HCO3)2 + Na2CO3 = CaCO3 + 2NaHCO3 Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O |
1. Применение кальцинированной соды Na2CO3 или ортофосфата натрия Na3PO4 CaSO4 + Na2CO3 = CaCO3 + Na2SO4; 3MgSO4 + 2Na3PO4 = Mg3(PO4)2 + 3Na2SO4 |
Автор: Гончаренко Л. И. (ula-books.com.ua)
Смотрите также:Растворимость карбоновых кислот в воде
Полисахариды. Целлюлоза и крахмал
Урок 68. Амины. Анилин (часть 1)