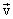Урок 9. Основные типы химической связи
Химия. Онлайн учебник → Основные типы химической связи
Химическая связь создается в результате взаимодействия атомов (или каких-либо частиц в веществе), которая обуславливает их соединение в молекулы (кристаллы).
В основу теории химической связи положены представления о том, что стойким является такое состояние атома, когда его внешний энергетический уровень окончен, то есть содержит 8 электронов (для элементов I периода - 2).
Основные типы химической связи
Водородная - связь, что создается между атомами Водорода одной молекулы и атомом сильно электроотрицательного элемента (O, N, P, F и т.д.) другой молекулы.
Агрегатное состояние (при норм. условиях): твердые и жидкие вещества (связь создается между молекулами H2O, спиртов, аминокислот и т.д.)
Металлическая - создается в результате взаимодействия относительно свободных электронов с ионами металлов.
Агрегатное состояние (при норм. условиях): твердые вещества (все металлы, кроме ртути).
Ковалентная - связь, которая создается при помощи общих электронных пар.
Ковалентная полярная - связь, во время создания которой происходит смещение электронных пар к более электроотрицательному атому.
Агрегатное состояние (н. у.): жидкие и газообразные вещества (HCl, H2O).
Ковалентная неполярная - связь, во время создания которой общая электронная пара размещается симметрично относительно обоих ядер атомов.
Агрегатное состояние (н. у.): газообразные, твердые, реже жидкие вещества (Cl2, F2, алмаз, графит).
Ионная связь - создается во время взаимодействия атомов, которые резко отличаются друг от друга значением электроотрицательности. В результате взаимодействия создаются ионы.
Агрегатное состояние (н. у.): твердые кристаллические вещества (NaCl, CaCO3).
Характеристики ковалентной связи
1. Кратность. Ковалентная химическая связь между двумя атомами, которая создана:
- одной парой электронов, называется одинарной (простой):
- H•+•H→H:H - создание молекулы водорода с атомов;
- двумя парами электронов, двойная:
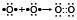 - создание молекулы кислорода;
- создание молекулы кислорода;- тремя парами электронов - тройной:
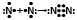 - создание молекулы азота.
- создание молекулы азота.
Двойную или тройную химическую связь, называют кратной.
Ковалентной связью соединяются атомы неметаллических элементов. Связь в молекуле изображают двумя способами:
- 1)
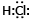 - электронной формулой,
- электронной формулой, - H•+•Cl→H:Cl - упрощенной электронной формулой;
- 2) H -- Cl - графической формулой.
2. Энергия. Энергия необходима для разрыва связи, то есть для разрушения молекулы на отдельные атомы. Ее измеряют в кДж/моль вещества.
3. Полярность. Во время взаимодействия атомов с одинаковой электроотрицательностью создаются молекулы с ковалентной неполярной связью (для простых веществ H2, Cl2, C).
При взаимодействии атомов, значения электроотрицательностей которых не очень отличается, происходит смещение общей электронной пары к более электроотрицательному атому и создаются молекулы с ковалентной полярной связью (сложные вещества: H2S, NH3, HF,CO2).
Различают Сигма (σ)- и пи (π)- ковалентные связи, которые отличаются характером перекрывания валентных орбиталей атомов, что взаимодействуют, а также симметрией распределения электронной густоты связи по отношению к линии, соединяющей центры двух атомов.
σ-связь - связь, во время создания которой перекрывание электронных облаков происходит по прямой, соединяющей центры двух атомов; σ-связь создается во врем я перекрывания s-s, s-p, p-p, а также гибридных орбиталей одна с другой и с не гибридными орбиталями.
π-связь - связь, при которой перекрывание электронных облаков происходит в площади, перпендикулярной к прямой, соединяющей центры атомов и проходит через эти центры; π-связь менее крепка чем σ-связь, она создается между атомами, которые уже соединены σ-связью.
Химическая связь: (часть 1) (часть 2)
Автор: Гончаренко Л. И. (ula-books.com.ua)
Смотрите также:
Амфотерные соединения и их свойства
Урок 18. Металлические элементы
Получение средних солей