Урок 16. Получение средних солей
Химия. Онлайн учебник → Получение средних солей
Изображение: www.chemistryrules.me.uk
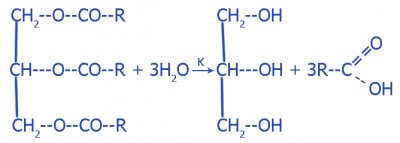
Соли - сложные вещества, состоящие с атомов металла и кислотного остатка (MmAn и Mm(EOn)p). Создаются катионами металлов и анионами кислотного остатка.
Соли бывают
1. Средние: NaNO3, KF, Ca3(PO4)2.
2. Кислые: NaHSO4, Ca(H2PO4)2.
3. Основные: Ca(OH)Cl, Cu(OH)2SO4.
4. Двойные: KAl(SO4)2, KNaSO4.
5. Смешанные: Ca(ClO)2, Al(NO3)Cl2.
6. Комплексные: K3[Al(OH)6].
Названия солей
CaCO3 - карбонат кальция, средняя соль.
Ca(HCO3)2 - кальций гидрогенкарбонат, кислая соль.
Название средней соли состоит из названия металла и названия кислотного остатка. В названиях кислых солей используется префикс - гидроген (водород) с обозначением числа атомов H в молекуле соли. Например:
Ca(H2PO4)2 - кальций дигидрогенортофосфат
Химические свойства средних солей
1. Взаимодействие с металлами. Более активные металлы вытесняют менее активные с растворов их солей:
Fe + CuSO4 = FeSO4 + Cu.
2. Взаимодействие с кислотами:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2;
K2SO3 + H2SO4 = K2SO4 + H2O + SO2;
CaCO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2.
3. Взаимодействие со щелочами. Создаются нерастворимые основания:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4.
Способы получения средних солей
1. Взаимодействие кислот с основами:
HCl + NaOH = NaCl + H2O;
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O.
2. Взаимодействие кислот с основными оксидами:
CaO + 2HCl = CaCl2 + H2O.
3. Взаимодействие кислот с металлами:
Mg + 2HCl = MgCl2 + H2.
4. Кислотные оксиды и щелочи:
CO2 + Ba(OH)2 = BaCO3 + H2O.
5. Соли и кислоты:
BaCl2 + H2SO4 = BaSO4 + 2HCl.
6. Соли и щелочи:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl;
7. Основные кислоты и оксиды:
CaO + CO2 = CaCO3;
8. Соли и соли:
NaSO4 + BaCl2 = BaSO4 + 2NaCl.
9. Соли и металлы:
CuCl2 + Fe = FeCl2 + Cu;
10. Соли и неметаллы:
2Al + 3Cl2 = 2AlCl3;
Ca + S = CaS.
Автор: Гончаренко Л. И. (ula-books.com.ua)
Смотрите также:
Хим. свойства и применение альдегидов
Урок 56. Альдегиды и кетоны. Примеры
Карбоновые (монокарбоновые) кислоты