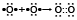Урок 21. Производство чугуна и стали. Доменный процесс
Химия. Онлайн учебник → Производство чугуна и стали. Доменный процесс
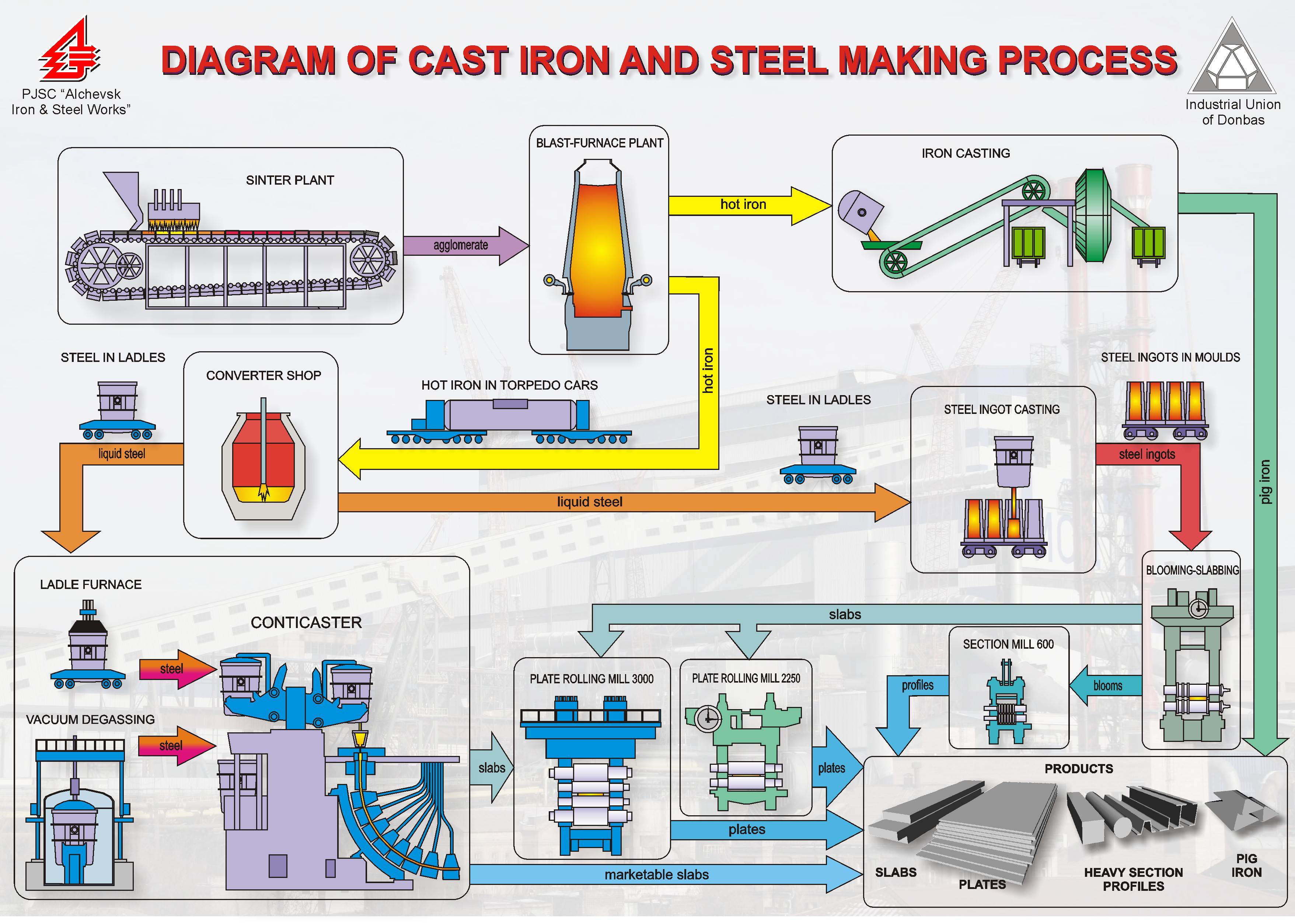
Чугун - сплав железа, в котором w(C) от 2 до 4,8%, а w(S, P, Si и т.д.) < 8%. Процесс производства чугуна основывается на восстановлении соединений Железа, содержащегося в рудах, до металла:
Fe(+3) + 3e → Fe(0)
Fe(+2) + 2e → Fe(0)
Стадии доменного процесса
1. Горение кокса и создание оксида карбона (II):
C + O2 (t) = CO2
C + O2 (t) = 2CO
2. Восстановление оксидов Железа оксидом карбона (II) и коксом:
|
3Fe2O3 + CO (t1) → 2Fe3O4 + CO2 Fe3O4 + CO (t2) → 3FeO + CO2 FeO + CO (t3) → Fe + CO2 |
t1 < t2 < t3 |
Кокс восстанавливает еще и примеси в руде - соединения Марганца, Кремния, Фосфора:
MnO + C (t) = Mn + CO
SiO2 + 2C (t) = Si + 2CO
Ca3(PO4)2 + 5C (t) = 2P + 3CaO + 5CO
Mn, Si, P растворяются в железе, а неметаллы еще и вступают с ним в реакцию с созданием Fe3Si, Fe3P.
Примеси соединений Сульфура окисляются кислородом до серного газа, а также превращаются на сульфиды CaS и FeS.
3. Реакции с участием флюсов. Флюсы - природные карбонаты (CaCO3, MgCO3):
CaCO3 (t) = CaO + CO2
CaO + SiO2 (t) = CaSiO3
MgCO3 + SiO2 (t) = MgSiO3 + CO2
Шлак - CaSiO3, MgSiO3, некоторые сульфиды (CaS, FeS). Кроме чугуна и шлака, из доменной печи выходит доменный газ - смесь CO, CO2, N2.
Производство стали
Сталь - сплав железа, где w(C) < 2%, а P и S содержится очень мало.
1. Конвертерный процесс. Используют железный металлолом, руду, известь, чугун. Основные химические реакции:
2C + O2 (t) = 2CO
Si + O2 (t) = SiO2
2Fe + O2 (t) = 2FeO
2FeO + Si (t) = 2Fe + SiO2
FeO + Fe3C (t) = 4Fe + CO
2. В мартеновской печи. Основные компоненты: чугун, обогащенная руда, металлолом, в котором присутствует немало ржавчины, используют природный газ в качестве топлива, добавляют флюсы - известь или глину. Шлаки содержат до 3% P.
Fe3PO4 + 4C (t) = 3Fe + 4CO
2Fe2O3 + 3FeS (t) = 7Fe + 3SO2
3. Производство в электропечах. При помощи электрического тока в них создается t > 2000 °C, что позволяет добывать металл с очень маленьким содержанием S и P.
Легированные примеси - Mn, Cr, Ni, W - улучшают свойства стали, дают ей стойкость к коррозии. Коррозия - процесс разрушения металлов в результате их химического взаимодействия с веществами окружающей среды.
Коррозия металла чаще всего происходит с участием воды и водных растворов электролитов. Ее скорость зависит от активности металла, температуры, кислотности среды. Железо ржавеет, из-за контакта с H2O на воздухе:
4Fe(0) + 3O2(0) + 6H20 = 4Fe(+3)(OH)3(-2)
Fe(0) - 3e → Fe(+3) | 4
O2(0) + 4e → 2O(-2) | 3
Металлы защищают от коррозии, покрывая их красками, лаками, другими металлами, смазывая маслами. Широкое применение приобрела нержавеющая сталь.
Металлы (часть 1) (часть 2) (часть 3) (часть 4)
Автор: Гончаренко Л. И. (ula-books.com.ua)
Синтетические органические вещества
Белки. Свойства и классификация
Аминокислоты. Изомерия