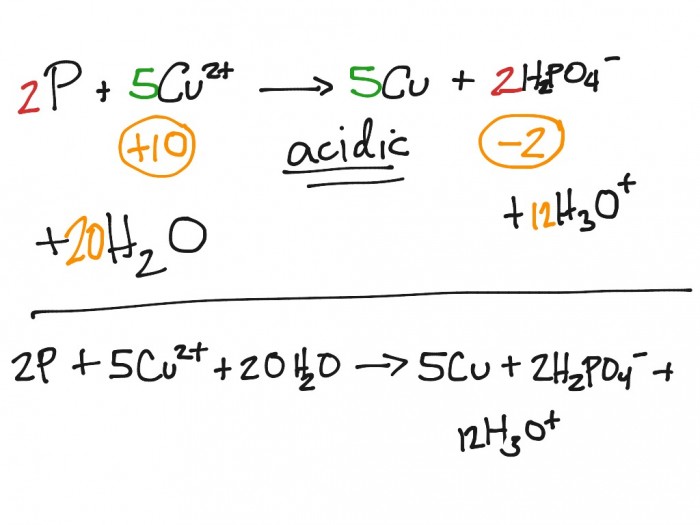Задача 29-32: Вывод формулы вещества
Химия. Онлайн учебник → Задача 29-32: Вывод формулы вещества
Решение задач на определение химической формулы вещества по количественным данным об реагентах и продуктах реакции
Задача 29
29. Определите истинную формулу углеводорода, массовая доля Углерода в котором составляет 0,857. Относительная густота его паров по воздуху равна 1,45.
|
CxHy w(C) = 0,857 Dвоз.(CxHy) = 1,45 |
Данные для определения формулы соединения CxHy:
Определение нижних индексов: x : y = n(C) : n(H) = (0,857 / 12) : (0,143 / 1) = 0,0715 : 0,143 = 1 : 2 Формула -- CH2. Расчет молярной массы по относительной густоте: M(CxHy) = 1,45 x 29 г/моль = 42 г/моль Отношение молярных масс CxHy и CH2: M(CxHy) / M(CH2) = 42 / 14 = 3, теперь 3 x CH2 = C3H6. Ответ: C3H6. |
|||||||||
| формула - ? |
Задача 30
30. Определите истинную формулу вещества, содержащего по массе 82,8 % Углерода и 17,2 % Водорода. Густота вещества при норм. услов. равна 2,59 г/л.
|
CxHy w(C) = 82,8 % w(H) = 17,2 % p(CxHy) = 2,59 г/л |
Данные для определения формулы соединения CxHy:
Определение нижних индексов: x : y = (0,828 / 12) : (0,172 / 1) = 0,069 : 0,172 = 1 : 2,5 = 2 : 5 Эмпирическая (простейшая) формула -- C2H5. Расчет молярной массы по относительной густоте: M(CxHy) = p x Vm = 2,59 г/л x 22,4 л/моль = 58 г/моль. По эмпирической формуле: M(C2H5) = 29 г/моль. Отношение молярных масс CxHy и C2H5: M(CxHy) / M(C2H5) = 58 / 29 = 2, теперь 2 x C2H5 = C4H10, Ответ: C4H10. |
|||||||||
| CxHy - ? |
Задача 31
31. Во время сжигания 2,3 г органического вещества в избытке кислорода создалось 4,4 г углерод (IV) оксида и 2,7 воды. Относительная густота паров этого вещества по водороду равна 23. С каких элементов состоит вещество? Определите его формулу.
|
m(CxHyOz) = 2,3 г O2 m(CO2) = 4,4 г m(CO2) = 2,7 г DH2 (CxHyOz) = 23 |
Mr(CO2) = 44; Mr(H2O) = 18 44 г CO2 -- 12 г C 4,4 г CO2 -- x г C x = (4,4 г x 12 г) / 44 г = 1,21 г C 18 г H2O -- 2 г H 2,7 г H2O -- x г H y = (2,7 г x 2 г) / 18 г = 0,3 г H m(O) = 2,3 - [m(C) + m(H)] = 2,3 - 1,5 = 0,8 г Расчет нижних индексов: C : H : O = (1,2 / 12) : (0,3 / 1) : (0,8 / 16) = 0,1 : 0,3 : 0,05 = 2 : 6 : 1 Эмпирическая (простейшая) формула C2H6O. M(CxHyOz) = 23 x 2 г/моль = 46 г/моль; по эмпирической формуле: M(C2H6O) = 46 г/моль. Истинная и эмпирическая формулы вещества одинаковы: C2H6O. Ответ: C2H6O. |
| формула - ? |
Задача 32
32. Во время сжигания 5,6 л газообразного углеводорода создалось 33 г CO2 и 13,5 г воды. Масса 1 л газа - 1,875 г. Определите формулу соединения.
|
V(CxHy) = 5,6 л O2 m(CO2) = 33 г m(H2O) = 13,5 г m(1 л газа) = 1,875 г |
Mr(CO2) = 44; Mr(H2O) = 18 44 г CO2 -- 12 г C 33 г CO2 -- x г C x = (33 г x 12 г) / 44 г = 9 г C 18 г H2O -- 2 г H 13,5 г H2O -- y г H y = (13,5 г x 2 г ) / 18 г = 1,5 г H 1 л -- 1,857 г CxHy 22,4 л -- z г CxHy z = (22,4 л x 1,857 г) x 1 л = 42 г C : H = (9 / 12) : (1,5 / 1) = 0,75 : 1,5 = 1 : 2 CH2 - эмпирическая (простейшая) формула Mr(CH2) = 14; Mr(CxHy) = 42; 42 / 14 = 3. Истинная формула: 3 x CH2 = C3H6 Проверка: 22,4 л -- 42 г 5,6 л -- x г x = 10,5 г m(C) + m(H) = 9 + 1,5 = 10,5 г Ответ: C3H6. |
| формула - ? |
Автор: Гончаренко Л. И. (ula-books.com.ua)
Смотрите также:
Задачи 33-34: Комбинированные
Решение задач по хим. формулам
Урок 4. Типы химических реакций