Урок 5. Теория окислительно-восстановительных реакций
Химия. Онлайн учебник → Теория окислительно-восстановительных реакций
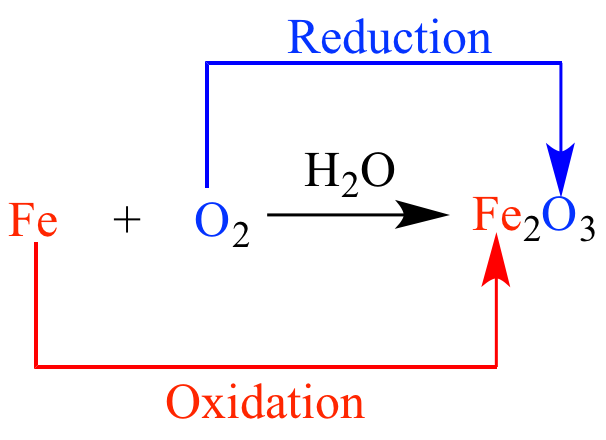
Внешние эффекты, сопровождающие химические реакции
- Создание осадка: AgNO3+HCl=AgCl+HNO3; (AgCl - белый осадок)
- Выделение газа: NaHCO3+HCl=NaCl+CO2+H2O; (CO2 - газ)
- Смена окраски: FeCl3+3KSCN=3KCl+Fe(SCN)3; (FeCl3 - желтый, 3KSCN - бесцветный, Fe(SCN)3 - красный)
- Появление запаха: FeS+2HNO3=Fe(NO3)2+H2S; (H2S - запах тухлый яиц)
- Выделение тепла: HCl+KOH=KCl+H2O+Q; (Q - тепло)
- Выделение тепла и света: CH4+2O2=CO2+2H2O+Q+hv. (Q - тепло, hv - свет)
Теория окислительно-восстановительных реакций
Атомы молекулы, или ионы, отдающие электроны и подвергаются окислению, называются восстановителями, а сам процесс отдачи электронов - окислением.
Примеры: Cu(0)-2e→Cu(2+); 2Br(-1)-2e→Br2(0); Fe(+2)-1e→Fe(+1);
Атомы молекулы, или ионы, присоединяющие электроны и подвергающиеся обновлению, называются окислителями, а сам процесс присоединения электронов - восстановлением.
Примеры: Al(+3)+3e→Al(0); S(-2)+2e→S(-2); Fe(+3)+1e→Fe(+2);
Восстановитель -е ⇔ Окислитель; Окислитель +е ⇔ Восстановитель;
Приметы окислительно-восстановительных реакций
- Степень окисления элемента в простом веществе равна нулю, а в соединении (оно создается в результате реакции) является плюсом или минусом.
- Процессы окисления и восстановления всегда сопровождают друг-друга. сколько электронов теряют одни частицы, столько электронов присоединяют другие. Теорию окислительно-восстановительных реакций предложил в 1914 г. отечественный ученый Л. В. Писаржевский.
Сложение уравнений окислительно-восстановительных реакций методом электронного баланса
1) Fe(0)+2H2SO4(+6)→Fe(+2)SO4+SO2(+4)+2H2O
| S(окислитель)(+6)+2е→S(+4) | 1 | S(+6) процесс восстановления |
| Fe(восстановитель)(0)-2е→Fe(+2) | 1 | Fe(0) процесс окисления |
2) 2Fe(0)+6H2SO4(+6)→Fe(+2)(SO4)3+3SO2(+4)+6H2O
| Fe(восстановитель)(0)-3е→Fe(+3) | 3 | 2 | процесс окисления | |
| 6 | ||||
| S(окислитель)(+6)+2е→S(+4) | 2 | 3 | процесс восстановления |
Проверку правильности написания уравнения можно ограничить подсчетом количества атомов одного любого элемента, например Водорода или Кислорода.
Ж. Гей-Люссак в 1808 г. открыл закон объемных соотношений газов: объем газов, вступивших в реакцию и создавшихся в результате реакции, соотносятся как простые целые числа.
Со временем ученые установили, что эти числа являются соответствующими коэффициентами в химических уравнениях.
Автор: Гончаренко Л. И. (ula-books.com.ua)
Химические реакции: (часть 1) (часть 2) (часть 3)
< Урок 4 | Химия. Онлайн учебник | Урок 6 >
Смотрите также:
Азот (N2) и соли аммония (NH4)
Cтроение и свойства Железа (Fe)
Электролиз расплава MgCl2