Урок 26. Электролиз расплава MgCl2
Химия. Онлайн учебник → Электролиз расплава MgCl2
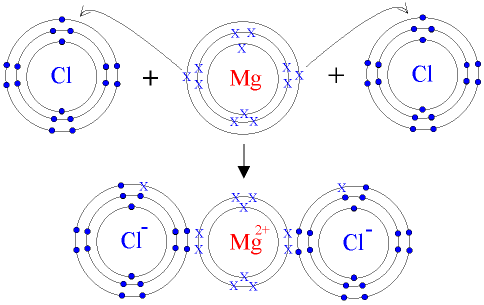
Электролиз - совокупность процессов, происходящих во время прохождения электрического тока через расплав или через раствор электролита.
MgCl2 ⇔ Mg2+ + 2Cl-
Во время прохождения тока через расплав MgCl2 катионы Магния под воздействием электрического поля двигаются к негативному электроду - катоду (К). Здесь, взаимодействуя с электронами, поступающими по внешнему кругу, катионы Магния восстанавливаются:
Mg(+2) + 2e = Mg(0)
Хлорид-ионы перемещаются к позитивному электроду - аноду (А) и, отдавая излишек электронов, окисляются. При этом первичным процессом является электрохимическая стадия - окисление хлорид-ионов:
2Cl- - 2e = 2Cl(0)
вторичным - связывание атомов хлора, которые создаются при этом, в молекулы:
2Cl(0) = Cl2(0)
Добавив уравнение процессов, происходящих возле электродов, получим суммарное уравнение окислительно-восстановительной реакции, происходящей во время электролиза расплава MgCl2:
Mg2+ + 2Cl- = Mg(0) + Cl2(0)
MgCl2(электролиз) = Mg(0) + Cl2(0)
Во время электролиза химическая реакция происходит за счет энергии электрического тока, который подводят извне.
Электролиз: (часть 1) (часть 2) (часть 3)
Автор: Гончаренко Л. И. (ula-books.com.ua)
< Урок 25 | Химия. Онлайн учебник | Урок 27 >
Смотрите также:
Решение задач по химическим формулам
Решение задач по уравнениям реакций
Задачи 33-34: Комбинированные задачи