Урок 27. Электролиз раствора KCl и K2SO4
Химия. Онлайн учебник → Электролиз раствора KCl и K2SO4
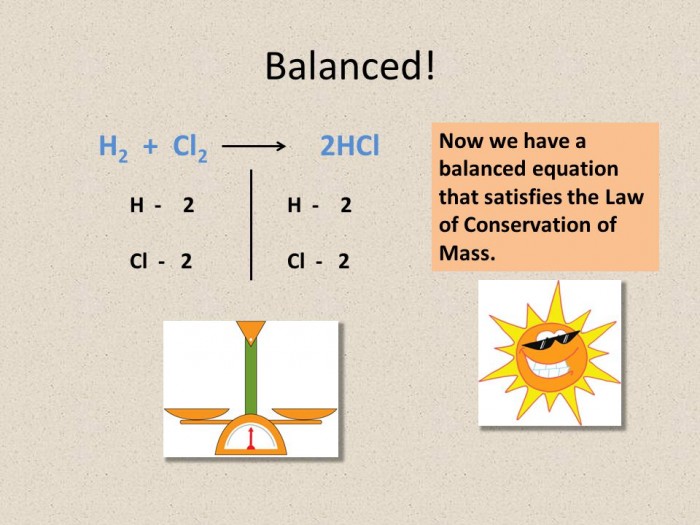
KCl
KCl ⇔ K+ + Cl- H2O ⇔ H+ + OH- | | K A
Если в растворе присутствуют анионы бескислородных кислот в смеси с OH-, значит:
K: 2H+ + 2e = 2H(0) A: 2Cl- - 2e = 2Cl(0) 2H(0) = H2(0) 2Cl(0) = Cl2(0)
Суммарное уравнение электролиза водного раствора KCl:
2KCl + H2O (электролиз) = 2KOH + H2(0) + Cl2(0)
или
2KCl + H2O (электролиз) = 2K+ + 2OH- + H2(K)(0) + Cl2(A)(0)
K2SO4
K2SO4 ⇔ 2K+ + SO42- 4H2O ⇔ 4H+ + 4OH- | | K A
Если в растворе соли кислоты содержащие кислород на аноде окисляются OH-, значит:
K: 4H+ + 4e = 2H(0) A: 4OH- - 4e = O2(0) + 2H2O 4H(0) = 2H2(0)
Суммарное уравнение:
K2SO4 + 4H2O (электролиз) = 2K+ + SO42- + 2H2(K)(0) + O2(0) + 2H2O
или
2H2O (электролиз) = 2H2(0) + O2(0)
Во время электролиза водных растворов, солей кислородсодержащих кислот, только вода поддается электролизу.
Электролиз: (часть 1) (часть 2) (часть 3)
Автор: Гончаренко Л. И. (ula-books.com.ua)
< Урок 26 | Химия. Онлайн учебник | Урок 28 >
Смотрите также:
Задачи. Количественный состав раствора
Задачи. Количественный состав смеси
Задачи. Определение массовой доли