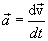Урок 40. Кремний (Si). Применение силикатов
Химия. Онлайн учебник → Кремний. Применение силикатов
Кремний может как отдавать, так и присоединять электроны, но его способность к присоединению электронов выражена немного слабее, чем у Углерода. Наиболее типичные для Si соединения, те в которых он проявляет степень окисления +4.
Получение кремния
В лаборатории:
SiO2 + 2Mg = Si + 2MgO + Q
Si - бурый порошок аморфного кремния
Кристаллический Si - твердое вещество с высокой t плавления, металлическим блеском, имеет полупроводниковые свойства и поэтому используется в электронике. Si бывает аморфный и кристаллический.
Химические свойства Кремния и его соединений
Кремний реагирует при повышении температуры с кислородом, хлором, серой, щелочами:
Si + O2 = SiO2 - оксид кремния (IV)
Si + 2Cl2 = SiCl4 - хлорид кремния (IV)
Si + 2S = SIS2 - сульфид кремния (IV)
Si + 2NaOH + H2O = Na2SiO3 + 2H2O
Na2SiO3 - метасиликат натрия
Оксид кремния (IV) (SiO2) - кислотный оксид бывает:
- кристаллический (очень твердый, tпл. = 1610 C, при комнатной температуре в воде не растворяется; никакая кислота не действует, кроме фтористой (HF);
- аморфный (прозрачная стеклообразная масса - кварцевое стекло).
SiO2 реагирует
1) с основными оксидами:
CaO + SiO2 = CaSiO3 - силикат кальция
2) со щелочами:
2KOH + SiO2 = K2SiO3 + H2O - силикат калия
3) с солями щелочных металлов:
SiO2 + K2CO3 = K2SiO3 + CO2
Кремниевая кислота (H2SiO3) - твердое бесцветное вещество, которое можно получить с ее соли (кремния) в виде вязкого осадка. H2SiO3 - слабая кислота, она идет в осадок с раствора под действием CO2 на кремниевые растворы. Во время добавления кислот к раствору силиката натрия создается вязкий осадок - гель кремниевой кислоты:
Na2SiO3 + H2SO4 = H2SiO3 + Na2SO4
Из искусственных силикатов очень важным является твердое стекло. Состав обычного стекла приблизительно соответствует формуле Na2O x CaO x 6SiO2. Его получают сплавкой смеси белого песка с содой и известняком (мелом):
CaCO3 + SiO2 = CaSiO3 + CO2
Na2CO3 + SiO2 = Na2SiO3 + CO2
Применение силикатов
1. Производство прозрачных аморфных сплавов, называющихся стеклом:
а) калиевое стекло - K2O x CaO x 6SiO2;
б) хрустальное стекло - K2O x PbO x 6SiO2;
в) оконное стекло - Na2O x CaO x 6SiO2;
2. Производство цемента, бетона, железобетона.
3. Производство строительной керамики (кирпич, черепица, трубы, облицовочные плиты), химически стойкой керамики и бытовой керамики.
Выявление оксида кремния (IV) и ионов CO32-, SiO32-
| Ион или вещество | Реактив | Результат реакции |
| CO32- | HCl, Ca(OH)2 |
CaCO3 + 2HCl = CaCl2 + H2O + CO2 CO2 + Ca(OH2) = CaCO3 + H2O |
| SiO32- | H2SO4 | Na2SiO3 + H2SO4 = H2SiO3 + Na2SO4 |
| CO2 | HCl, Ca(OH)2 |
CaCO3 + 2HCl = CaCl2 + H2O + CO2 CO2 + Ca(OH)2 = CaCO3 + H2O |
Автор: Гончаренко Л. И. (ula-books.com.ua)
< Урок 39 | Химия. Онлайн учебник | Урок 41 >
Смотрите также:
Применение простых веществ Углерода
Классификация органических соединений
Хим. связь в молекулах органических соед.