Урок 41. Химическая связь в молекулах органических соединений
Химия. Онлайн учебник → Химическая связь в молекулах органических соединений
Органические вещества - это соединения Углерода. В состав молекул органических соединений, кроме атомов Углерода, входят атомы Водорода, часто - еще и Кислорода, Азота, иногда - Серы, Фосфора. Все эти элементы называются элементами-органогенами.
Особенности состава, строение и свойства неорганических и органических соединений
| Признаки | Вещества | |
| Неорганические | Органические | |
| Качественный состав | Наличие Углерода не является обязательным в соединениях CO2, KCl, Na2SO4. Углерод имеет валентность II и IV. | Обязательное наличие Углерода в соединениях C2H6, HCOOH, CH3OH. Углерод всегда имеет валентность IV. |
| Строение | Молекулярное и не молекулярное | Обычно молекулярное |
| Химическая связь | Ковалентная (полярная и неполярная), ионная и металлическая | Почти всегда ковалентный |
| Агрегатное состояние | Газы, жидкости, твердые вещества с низкими или высокими tпл. и tкип. | Газы, жидкости, твердые вещества с низкими tпл. и tкип. |
| Отношение к нагреванию |
Могут распадаться во время нагревания или плавиться без распада CaCO3 (t) ⇔ CaO + CO2 |
Во время сильного нагревания без кислорода распадаются с созданием углерода CH4 (t) = C + 2H2 |
| Горение |
Горят или не горят. Во время горения не обязательно создается CO2: C + O2 (t) = CO2 4NH3 + 3O2 (t. k) = 6H2O + 2N2 |
Почти все горят, при этом создаются CO2 и H2O: C2H4 + 3O2 = 2CO2 + 2H2O C2H5OH + 3O2 = 2CO2 + 3H2O |
Химическая связь в молекулах органических соединений
Энергия связи - энергия, необходимая для разрыва связи (кДж/моль). Длина связи - расстояние между ядрами атомов после создания между ними химической связи (нм).
Способность атомов брать участие в создании ограниченного числа ковалентных связей - насыщенность ковалентной связи. Ковалентные связи, созданные многовалентными атомами всегда имеют пространственную направленность. Углы между связями называют валентными.
Ковалентная связь между двумя атомами, созданная одной парой электронов, называют одинарной (простой), двумя парами электронов - двойной, тремя парами электронов - тройной. Двойные или тройные химические связи называются кратными.
Ковалентные связи различают как сигма (σ)- и пи (π)-ковалентные связи, отличающиеся характером перекрывания валентных орбиталей атомов, которые взаимодействуют, а также симметрией распределения электронной густоты связи по отношению к линии, соединяющей центры двух атомов.
Молекулярное строение углеводородов
| Углевод. общая формула |
Алканы CnH2n+2 |
Алкены CnH2n |
Алкины CnH2n-2 |
Арены CnH2n-6 |
| Тип гибридиз. атомных орбиталей атомов Углерода | sp3 | sp2 | sp | sp2 |
| Валент. угол | 109° 28' | 120° | 180° | 120° |
| Хим. связи | Простые (одинарные) σ-связи | Наличие одной двойной связи (σ- и π-) | Наличие одной σ- и двух π-связей | Аромат.соед. σ- и π-связей. |
| Длина связей |
C--C - 0,154 нм C--H - 0,198 нм |
C=C - 0,134 нм | C=C - 0,120 нм | C--C - 0,140 нм |
| Энергия связей |
C--C-347 кДж/моль C--H-432 кДж/моль |
C=C-615 кДж/моль | C=C-812 кДж/моль | C--C-412 кДж/моль |
Основные положения теории химического строения органических веществ О. М. Бутлерова
1. Атомы в молекулах соединены между собой в определенном порядке химическими связями соответственно к их валентность (Углерод - IV, Водород - I, Кислород - II).
| Структурные формулы | |
| полные | сокращенные |
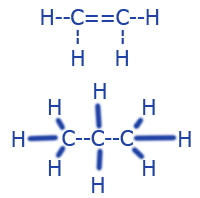 |
CH2==CH2 CH3--CH2--CH3 |
2. Свойства вещества определяются не только его качественным составом, но и строением. Это утверждение объясняет явление изомерии:
CH3--CH2--CH2--CH2--OH - бутан-1-ол
C2H5--O--C2H5 - диэтиловый эфир, метоксиметан.
Молекуле C4H10O отвечают два вещества, разные по строению, а соответственно - и по свойствам.
Изомеры - соединения, имеющие одинаковый количественный и качественный состав, но разное химическое строение.
3. Атомы и группы атомов, создавшие молекулу, взаимно влияют друг на друга, от чего зависит реакционная способность молекулы.
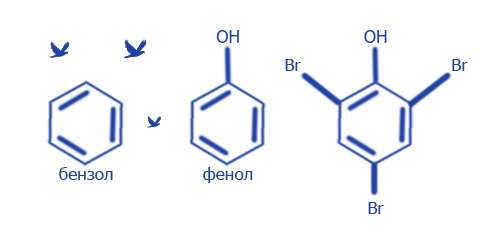
| C6H6 + Br2 (вода) → | C6H5OH + 3Br2 (вода) → | C6H2Br3OH + 3HBr |
Основы органической химии (часть 1) (часть 2) (часть 3) (часть 4) (часть 5)
Автор: Гончаренко Л. И. (ula-books.com.ua)
< Урок 40 | Химия. Онлайн учебник | Урок 42 >
Смотрите также:
Получение азотной кислоты (HNO3)
Структур. и пространственная изомерия
Урок 35. Химические свойства NO2