Урок 34. Получение азотной кислоты (HNO3)
Химия. Онлайн учебник → Получение азотной кислоты (HNO3)
HNO3 - азотная кислота
Чистая кислота при обычных условиях - бесцветная жидкость с неприятным запахом, тяжелее воды. Летучая. Смешивается с H2O в любых соотношениях, создавая при этом раствор.
Сильная одноосновная кислота. В разбавленных растворах почти полностью диссоциирует на ионы:
HNO3 ⇔ H+ + NO3-
Химические свойства
1. Взаимодействие с металлами:
а) концентрированная HNO3 с созданием NO2 - оксида азота (II):
Pb(0) + 4HN(+5)O3 (конц.) = Pb(+2)(NO3)2 + 2N(+4)O2 + 2H2O
Pb(0) - 2e → Pb(+2) | 1
N(+5) + e → N(+4) | 2
б) разбавление (20--30%) HNO3 с созданием оксида азота (II) или оксида азота (I):
3Cu(0) + 8HN(+5)O3 (конц.) = 3Cu(+2)(NO3)2 + 2N(+2)O + 4H2O
Cu(0) - 2e → Cu(+2) | 3
N(+5) + 3e → N(+2) | 2
4Mg(0) + 10HN(+5)O3 (разб.) = 4Mg(+2)(NO3)2 + N2(+1)O + 5H2O
Mg(0) - 2e → Mg(+2) | 8 | 4
2N(+5) + 8e → 2N(+1) | 2 | 1
в) во время реакции очень разбавленной (меньше 10%) HNO3 с металлами создается нитрат аммония:
4Zn(0) + 10HN(+5)O3 = 4Zn(+2)(NO3)2 + NH4NO3 + 3H2O
Zn(0) - 2e → Zn(+2) | 8 | 4
N(+5) + 8e → N(-3) | 2 | 1
2. Взаимодействие с основными и амфотерными оксидами:
CuO + 2HNO3 = Cu(NO3)2 + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
3. Взаимодействие с основаниями:
NaOH + HNO3 = NaNO3 + H2O
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
4. Взаимодействие с солями:
CaCO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2
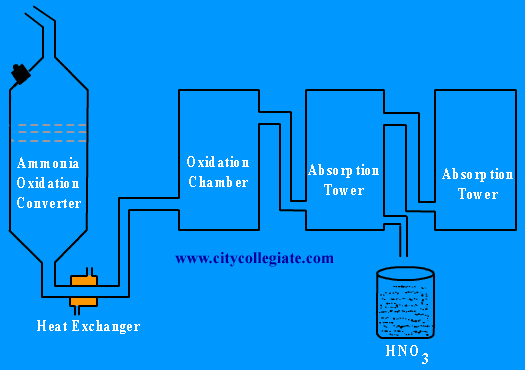
Получение HNO3
1. В промышленности:
а) синтез аммиака:
N2 + 3H2 (t. p. k) ⇔ 2NH3 + Q
б) каталитическое окисление аммиака кислородом воздуха:
4NH3 + 5O2 (t. k) ⇔ 4NO + 6H2O + Q
в) окисление NO до NO2 и растворение NO2 в воде:
2NO + O2 = 2NO2
4NO2 + 2H2O + O2 = 4HNO3
2. В лаборатории:
KNO3 + H2SO4 (конц.) (t) = HNO3 + KHSO4
Азот: (часть 1) (часть 2) (часть 3)
Автор: Гончаренко Л. И. (ula-books.com.ua)
< Урок 33 | Химия. Онлайн учебник | Урок 35 >
Смотрите также:
Сера. Хим. свойства и применение
Строение и свойства Железа (Fe)
Азот (N2) и соли аммония (NH4)