Урок 13. Химические свойства солеобразующих оксидов
Химия. Онлайн учебник → Химические свойства солеобразующих оксидов
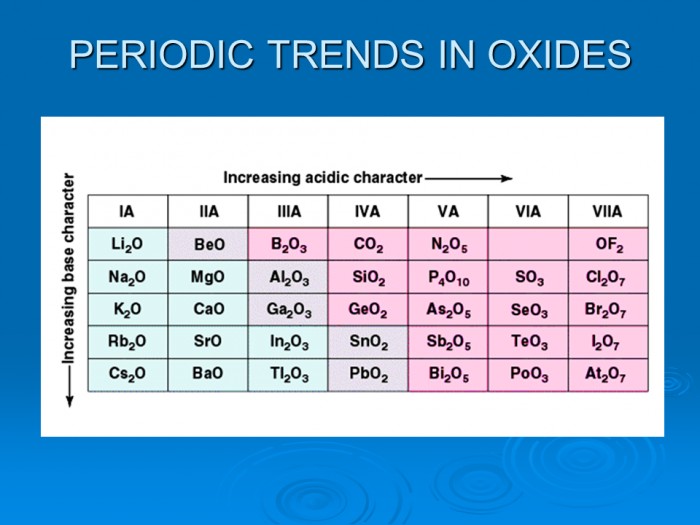
Изображение: www.sliderbase.com.
Оксиды - сложные вещества, состоящие из атомов двух элементов один из которых - Кислород (EmOn).
| - | Солеоб. | - | Несолеоб. |
| кислотные | основные | амфотерные | - |
| создают неметалл. элементы и металлы с валентн. V-VII (SO3, Mn2O7) | создают металлы с валентн. I, II (Li2O, CaO) | создают металлы с валентн. III, IV (Al2O3), исключение: BeO, PbO, ZnO, SnO | N2O, NO, CO, SiO |
Добывание оксидов
1. Взаимодействие простых веществ с кислородом:
Ca + O2 (t) = 2CaO,
4P + 5O2 = 2P2O5
2. Разложение гидроксидов:
Ca(OH)2 (t) = CaO + H2O,
Zn(OH)2 (t) = ZnO + H2O,
Cu(OH)2 (t) = CuO + H2O
3. Разложение кислот и солей кислот, в составе которых есть кислород (нитратов, карбонатов, сульфатов):
BaCO3 (t) = BaO + CO2,
2Mg(NO3)2 (t) = 2MgO + 4NO2 + O2,
H2CO3 = H2O + CO2
Химические свойства солеобразующих оксидов
1. Отношение к воде:
- оксиды щелочных и щелочноземельных металлов с водой создают щелочи:
Li2O + H2O = 2LiOH - литий гидроксид,
CaO + H2O = Ca(OH)2 - кальций гидроксид.
- кислотные оксиды с H2O создают соответствующие кислоты (кроме SiO2):
SO3 + H2O = H2SO4 - сульфатная кислота,
P2O5 + 3H2O = 2H3PO4 - ортофосфорная кислота.
2. Отношение к кислотам:
- основные и амфотерные оксиды взаимодействуют с кислотами, создают соли и воду:
CuO + 2HCl = CuCl2 + H2O,
Al2O3 + 6HCl = 2AlCl3 + 3H2O
- во время избытка многоосновной кислоты создается кислая соль:
CaO + 2H3PO4 (изб.) = Ca(H2PO4)2 + H2O
В случае избытка оксида, которому соответствует много кислотная основа, создается основная соль:
MgO (изб.) + HCl = Mg(OH)Cl
3. Отношение к основам:
- оксиды щелочных и щелочноземельных металлов во время сплавления реагируют с амфотерными основами:
Na2O + 2Al(OH)3 = 2NaAlO3
- амфотерные оксиды взаимодействуют только с щелочами:
во время сплавления твердых веществ создается средняя соль:
ZnO + 2NaOH(тв.) (t) = NaZnO2 + H2O;
в растворе создается комплексная соль:
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4];
- кислотные оксиды взаимодействуют, создают соли и воду:
с щелочами:
CO2 + 2NaOH = Na2CO3 + H2O;
с нерастворимыми основами (во время сплавления):
SiO2 + Mg(OH)2 (t) = MgSiO3 + H2O;
4. Отношение к солям. Реагируют только во время сплавления:
Al2O3 + K2CO3 (t) = 2KAlO2 + CO2,
3SiO2 + Ca3(PO4)2 (t) = 2CaSiO3 + P2O5;
Оксиды имеют химические названия, а некоторые - еще и тривиальные. Первое слово в химическом названии оксида является названием соответствующего элемента, а второе - "оксид": SO3 - оксид серы(VI), SO2 - оксид серы (IV), FeO - оксид железа (II).
Автор: Гончаренко Л. И. (ula-books.com.ua)
Смотрите также:
Углерод и модификации (алмаз, графит, карбин)
Углерод. Химические свойства оксидов
Галогены Cl2 и HCl (часть 1)