Урок 37. Углерод. Аллотропные модификации (алмаз, графит, карбин)
Химия. Онлайн учебник → Углерод. Аллотропные модификации (алмаз, графит, карбин)
Аллотропные модификации Углерода
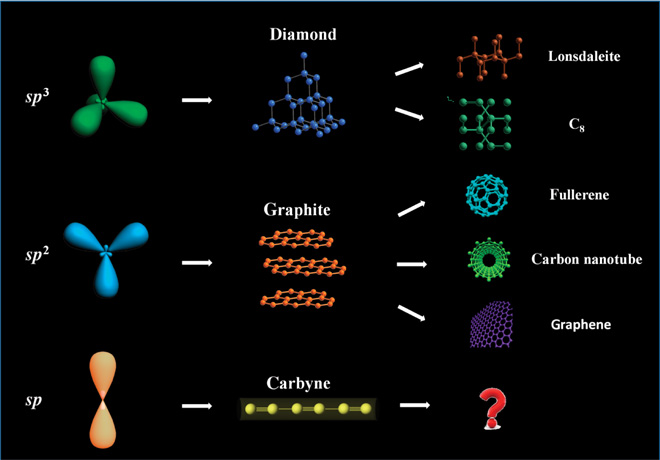
1. Алмаз - бесцветное кристаллическое вещество с атомной решеткой. Атомы Углерода в кристаллах пребывают в состоянии sp3-гибридизации. Они связаны крепкими ковалентными неполярными связями.
Каждый атом C окружен четырьмя другими, расположенными от него в направлениях от центра тетраэдра к его вершинам. Все это обуславливает твердость и значительную густоту. Алмаз плохо проводит тепло, практически не проводит электрический ток. В чистом состоянии сильно преломляет свет.
2. Графит - темно-серое кристаллическое вещество со слабым металлическим сиянием. Атомы Углерода в кристаллах пребывают в состоянии sp2-гибридизации.
Они соединены в пласты (шары), состоящие из шестигранников. В них каждый атом C соединен крепкими ковалентными связями с тремя соседними атомами. связи направлены друг к другу под углом 120°.
Четвертый валентный электрон каждого атома в шаре остается подвижен, как в металле, может перемещаться от одного атома C к другому. Этим объясняется высокая электрическая проводность, но ниже, чем у металлов, а также его теплопроводность, и металлический блеск.
Расстояние между шарами в графите достаточно высокое (0,335 нм), а силы взаимодействия между ними сравнительно слабые, поэтому он расщепляется на тонкие скалки, которые сами по себе очень крепкие. Последние, в свою очередь, легко прилипают к бумаге.
3. Карбин - мелкокристаллический порошок черного цвета. Кристаллы состоят с линейных цепей углеродных атомов, соединенных одинарными и тройными связями, которые чередуются: (--C=C--)n.
По твердости обгоняет графит, но поступается алмазу. Имеет полупроводниковые свойства. Во время нагревания к 2800 °C без доступа воздуха превращается в графит.
Аморфный углерод (Уголь)
Создается в результате нагревания соединений Углерода без доступа воздуха и имеет скрытое кристаллическое строение графита. В зависимости от природы исходящих веществ существуют следующие виды угля: древесный, костяной, кокс, сажа.
Уголь (особенно древесный) имеет большую адсорбционную способность.
Адсорбция - способность угля и других твердых или жидких веществ удерживать на своей поверхности пары, газы и растворенные вещества.
Вещества, на поверхности которых происходит адсорбция, называются адсорбентами. Вещества, которые адсорбируют, называются адсорбатами.
Адсорбционная способность угля объясняется его пористостью. Для усиления адсорбции уголь специально обрабатывают - нагревают в струе водяного пара, чтобы освободить его поры от загрязняющих веществ. Обработанный таким способом уголь называют активированным.
Углерод: (часть 1) (часть 2) (часть 3)
Автор: Гончаренко Л. И. (ula-books.com.ua)
< Урок 36 | Химия. Онлайн учебник | Урок 38 >
Смотрите также:
Урок 22. Натрий (Na) и Калий (K)
Mg и Ca. Электронное строение атомов
Алюминий. Химическое взаимодействие