Урок 12. Диссоциация сильных и слабых электролитов
Химия. Онлайн учебник → Диссоциация сильных и слабых электролитов
Основные положения электролитической диссоциации С. Аррениуса (1883)
a = N / N0
a - степень электролитической диссоциации, N - количество молекул, распавшихся на ионы; N0 - общее количество молекул в растворе.
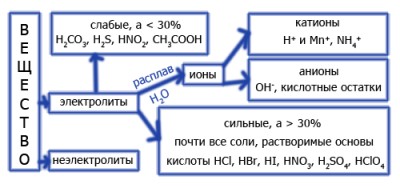
Диссоциация электролитов
|
Диссоциация сильных электролитов: - кислот |
HCl = H+ + Cl- H2SO4 = 2H+ + SO42- |
| - основ |
Na(OH) = Na+ + OH- Ba(OH)2 = Ba2+ + 2OH- |
| - солей |
Na3PO4 = 3Na+ + PO43- KCl = K+ + Cl- |
| Диссоциация слабых электролитов происходит ступечато |
H2S ⇔ H+ + HS- 1 степень HS- ⇔ H+ + S2- 2 степень H3PO4 ⇔ H+ + H2PO4 1 степень H2PO4- ⇔ H+ + HPO42- 2 степень HPO42- ⇔ H+ + PO43- 3 степень |
H2O - слабый электролит. H2O ⇔ H+ + OH-
Связь, создающая между атомами Водорода одной молекулы и атомом сильно электроотрицательного элемента (O, S, N, F и т.д.) другой молекулы, называется водородной.
Окраска индикаторов (среда)
| Индикатор | Кислая | Щелочная | Нейтральная |
| универсальный | розовый | синий | желтый |
| лакмус | розовый | синий | фиолетовый |
| фенолфталеин | бесцветный | малиновый | бесцветный |
| метилоранж | розовый | малиновый | оранжевый |
Ионно-молекулярное уравнение - уравнение, содержащее формулы веществ и формулы ионов. Реакции обмена между электролитами в растворе - реакции между ионами в растворах электролитов.
Условия, при которых реакции обмена между электролитами в растворе происходят до конца
| Условие | Молекулярное и ионно-молекулярное уравнение |
| 1. Создание осадка |
MgCl2 + 2NaOH = Mg(OH)2 + 2NaCl Mg2+ + 2Cl- + 2Na+ + 2OH- = Mg(OH)2 + 2Na+ + 2Cl- Mg2+ + 2OH- = Mg(OH)2 |
| 2. Создание газа |
Na2CO3 + 2HCl = 2NaCl + H2CO3 (H2O + CO2) 2Na+ + CO32+ + 2H+ 2Cl- = 2Na+ + 2Cl- + H2O + CO2 CO32+ + 2H+ = H2O + CO2 |
| 3. Создание слабого электролита или H2O |
KOH + KCl = KCl + H2O K+ + OH- + H+ + Cl- = K+ + Cl- + H2O H+ + OH- = H2O |
Автор: Гончаренко Л. И. (ula-books.com.ua)
Смеси веществ. Растворы: (часть 1) (часть 2)