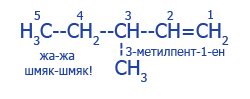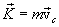Урок 47. Алкены. Химические свойства и изомерия
Химия. Онлайн учебник → Алкены. Химические свойства и изомерия
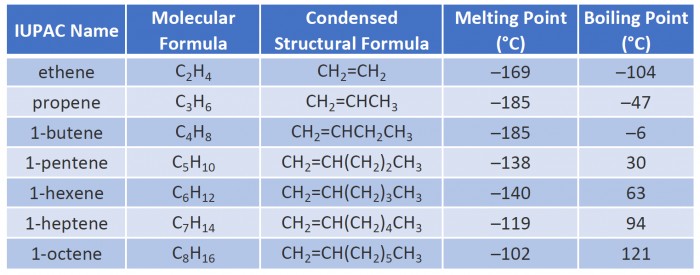
| Общая формула: CnH2n | ||
| Валентный угол: 120° | ||
| Тип гибридизации атомных орбиталей атомов Углерода: sp2 | ||
| Химические связи: наличие одной двойной связи (одна сигма-, а вторая - пи-) | ||
| Длина связи: C=C составляет 0,134 нм | ||
| Энергия связей: C=C составляет 615 кДж/моль | ||
| Номенклатура: название соответствующего алкана с заменой суффикса -ан на -ен | ||
|
Наиболее важные одновалентные радикалы:
|
Вид изомерии
| Структурная | |
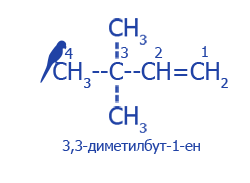
| Распределение углеродного скелета |
CH3--CH2--CH2--CH2--CH=CH2 - гекс-1-ен
|
| Положение двойной связи |
CH3--CH2--CH2--CH=CH2 - пент-1-ен CH3--CH2--CH=CH--CH3 - пент-2-ен |
| Межклассовая | |
|
Алкены изомерные циклоалканам: CH3--CH2--CH2--CH=CH2 - пент-1-ен
|
|
| Пространственная (геометрическая) | |
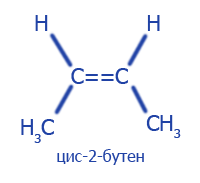 |
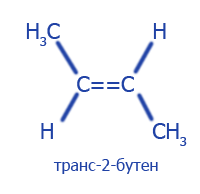 |
Химические свойства алкенов
| Реакция соединения. Присоединения к CH3--CH=CH2 | |
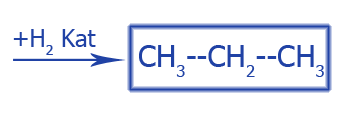 |
Гидрирование |
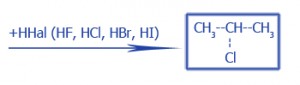 |
Галогенирование |
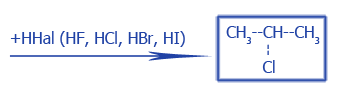 |
Гидрогалогенирование (по правилу Марковникова) |
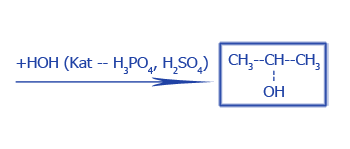 |
Гидратация |
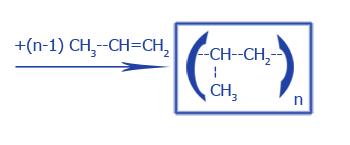 |
Полимеризация |
| Окисление CH2=CH2 при мягких условиях без разрыва C--C связей | |
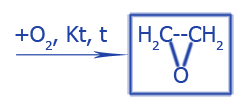 |
Создаются эпоксиды (циклические эфиры) |
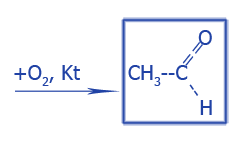 |
Уксусный альдегид (Ацетальдегид) |
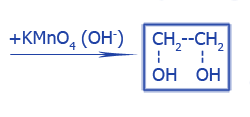 |
Этиленгликоль |
| Окисление CH2=CH2 при жестких условиях с разрывом C--C связи | |
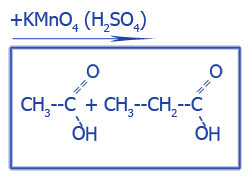 |
Уксусная, пропионовая кислота (этановая, пропановая) |
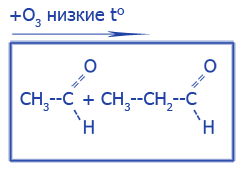 |
ацетальдегид и пропаналь |
| Замещение Водорода в аллильном положении CH3--CH=CH2 | |
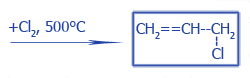 |
Термическое хлорирование |
Получение алкенов
1. Крекинг нефти:
а) термический (t ≈ 600 : 750 °C);
б) каталитический (t ≈ 300 : 500 °C);
Катализаторы: алюмосиликаты, хлорид алюминия. Создается смесь алкенов и алканов:
| CH3--CH2--CH2--CH2--CH2--CH3 (t)--| | → CH2=CH2 + CH3--CH2--CH2--CH3 |
| → CH3--CH=CH2 + CH3--CH2--CH3 | |
| → CH3--CH--CH=CH2 + CH3--CH3 | |
| → CH3--CH2--CH2--CH=CH2 + CH4 |
2. Дегидратация алкенов:
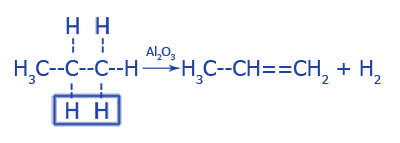
3. Отцепление галогеноводородов от алкилгалогенидов (дегидрогалогенирование):
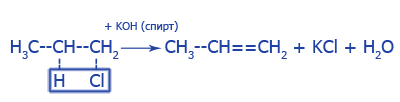
4. Отцепление воды от спиртов (дегидратация):
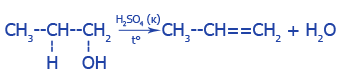
5. Отцепление двух атомов галогенов от соседних атомов Углерода под действием цинка:
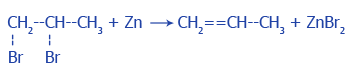
6. Частичное гидрирование алкинов:
C2H2 + H2 (kt) → CH2=CH2
Качественные реакции на алкены
1. Взаимодействие с бромной водой. Желто-коричневая бромная вода теряет цвет:
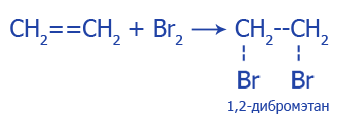
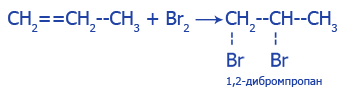
2. Взаимодействие с раствором перманганата калия (KMnO4), темно-фиолетовый раствор теряет цвет:
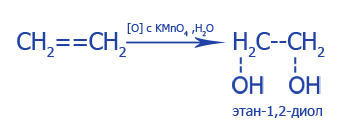
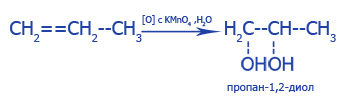
Применение алкенов
1. Производство полиэтилена, полипропилена.
2. Производство этанола.
3. Производство 1,2-дихлорэтана.
Автор: Гончаренко Л. И. (ula-books.com.ua)
< Урок 46 | Химия. Онлайн учебник | Урок 48 >
Смотрите также:
Источники углеводородов - газ, нефть, уголь
Свойства одноатомных спиртов. Реакции
Насыщенные одноатомные спирты