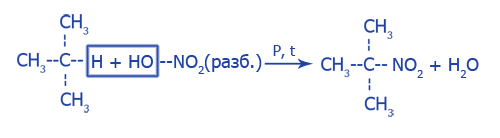Урок 46. Алканы. Получение и применение
Химия. Онлайн учебник → Алканы. Получение и применение
www.masterorganicchemistry.com
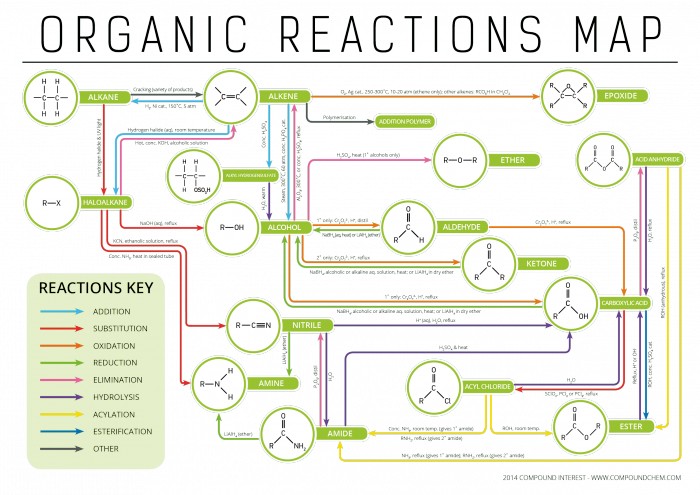
| Общая формула: CnH2n+2 |
| Валентный угол: 109° 28' |
| Тип изомерии: структурная изомерия |
| Тип гибридизации атомных орбиталей атомов Углерода: sp3 |
| Химические связи: простые (одинарные) σ-связи (сигма связи) |
| Длина связей: C--C составляет 0,154 нм, C--H составляет 0,109 нм |
| Энергия связей: C--C составляет 347 кДж/моль, C--H составляет 432 кДж/моль |
| Номенклатура алканов: метан, етан, пропан, бутан, а дальше название на греческом + суффикс -ан. |
| Названия одновалентных радикалов: название соответственного алкана с заменой суффикса -ан на -ил. |
| Метан - бутан - газы, C5H12--C16H34 - жидкости, а с C17H36 - твердые вещества. В гомологическом ряду алканов наблюдается закономерное повышение температур кипения и плавления, увеличение густоты |
Химические свойства
| Реакция с разрывом C--H связей |
|
Замещение Водорода на галоген (F, Cl, Br) - галогенирование: CH4 + Cl2 (h, v) → CH3Cl + HCl CH3Cl + Cl2 (h, v) → CH2Cl2 + HCl CH2Cl2 + Cl2 (h, v) → CHCl3 + HCl CHCl3 + Cl2 (h, v) → CCl4 + HCl |
|
Замещение водорода на нитрогруппу (реакция Коновалова): C2H6 + HNO3 (разб.) (p, t) → C2H5NO2 + H2O
|
|
Расщепление - каталитическая дегидрогенизация, создаются алкены: CH3--CH2--CH2--CH3 (Cr2O3) → CH3--CH2--CH==CH2 + H2 |
| Реакция с разрывом C--C связей |
|
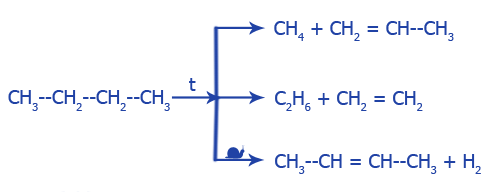
Расщепление (крекинг, пиролиз), создаются алкены:
|
|
Горение (полное окисление): 2CnH2n+2 + (3n + 1)O2 → 2nCO2 + (2n + 2)H2O 2C2H6 + 7O2 → 4CO2 + 6H2O |
|
Частичное окисление с созданием органических соединений содержащих кислород: CH4 (O2) → CH3OH C4H10 (O2) → 2CH3COOH |
|
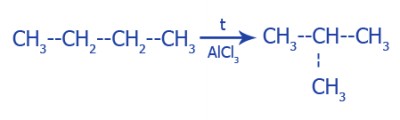
Изомеризация: |
Реакции, свойственные для метана
Пиролиз
а) CH4 (t = 1000° C) → C + 2H2
б) пиролиз с одновременным окислением в присутствии водяного пара:
2CH4 + O2 (1500° C) → 2CO + 4H2
2CO + 4H2 - синтез-газ
Как остаточный продукт еще создается ацетилен (этин):
2CH4 (1500° C) → CH = CH + 3H2
Конверсия
а) с водяным паром: CH4 + H2O (t) → CO + 3H2
б) с углекислым газом: CH4 + CO2 (t) → 2CO + 2H2
Неполное окисление метана
4CH4 + 2O2 (500° C) → C2H2 + H2O + CO2 + CO + 6H2
Получение алканов
1. Природные источники: газ, нефть, уголь, торф, древесина.
2. Синтетические промышленные методы:
а) CH4 получают во время взаимодействия торфа и графита:
C + 2H2 (Ni, t°) → CH4
б) алканы получают с чадного газа и водорода, входящих в состав водяного пара:
nCO + (2n + 1)H2 → CnH2n+2 + nH2O
CO + 3H2 → CH4 + H2O
3. Лабораторные методы:
а) взаимодействие карбида алюминия с водой:
Al4Cl3 + 12H2O = 4Al(OH)3 + 3CH4
б) метан получают во время нагревания смеси ацетата натрия гидроксидом (реакция Дюма):
CH3COONa + NaOH (t) = CH4 + Na2CO3
реакция декарбоксилирования
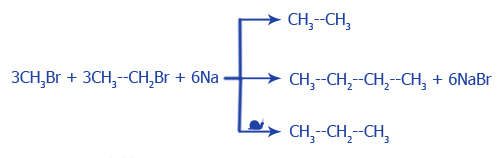
в) алканы получают во время взаимодействия металлического натрия и галогенопроизводных углеводородов (реакция Вюрца):
2CH3--CH2Br + 2Na → CH3--CH2--CH2--CH3 + 2NaBr
Во время использования галогенопроизводных различных алканов создается смесь насыщенных углеводородов:
г) электролиз водяных растворов натриевых или калийных солей углеродных кислот (реакция Кольбе):
2CH3COO- - 2e (I) → C2H6 + 2CO2 (I - электрический ток).
Алканы используют
1) в качестве топлива.
2) для производства пластмасс.
3) для получения синтетических моющих средств.
4) изомеры алканов используют в производстве высококачественных бензинов и каучуков.
Автор: Гончаренко Л. И. (ula-books.com.ua)
< Урок 45 | Химия. Онлайн учебник | Урок 47 >
Смотрите также:
Бензол. Строение бензольного ядра
Карбоновые (монокарбоновые) кислоты
Хим. свойства и применение альдегидов