Урок 69. Амины. Анилин (часть 2)
Химия. Онлайн учебник → Амины. Анилин (часть 2)
Анилин - C6H5--NH2
Свободная пара электронов Азота вступает в сопряжение (р, п-сопряжение) с п-электронами бензольного ядра, в результате чего электронная густота на атоме Азота понижается и доступ протона к свободной электронной паре усложняется.
Ароматические амины - более слабые основания, чем аммиак и насыщенные амины. Раствор анилина не изменяет окраски индикаторов.
Повышение электронной густоты бензольного ядра в орто- и пара-положениях увеличивает его активность до реакций замещения.
Химические свойства анилина
1. Реакция с участием аминогруппы. Взаимодействие с сильными минеральными кислотами:
C6H5NH2 + HCl → C6H5NH3Cl - хлорид фениламмония (легкорастворимая в воде соль)
C6H5NH2 + H2SO4 → C6H5NH3HSO4 - (тяжело растворимая в воде соль)
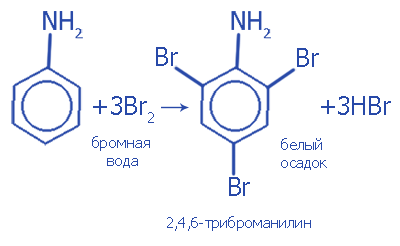
2. Реакция с участием бензольного ядра. Галогенирование (качественная проба на анилин):
Анилин получают восстановлением ароматических соединений содержащих азот в ароматические амины - реакция Зинина:
C6H5NO2 + 6H (k) → C6H5NH2 + 2H2O
C6H5NO2 - нитробензол, C6H5NH2 - анилин
Основные свойства аминов
Амины - органические основы. Насыщенные амины - слабые основания, но они сильнее чем аммиак. Это обусловлено тем, что алкильные группы в молекуле алкиламина смещают электронную густоту в сторону атома Азота, и его способность к соединению с катионом H+ увеличивается.
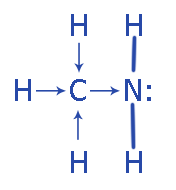
Так-как молекула вторичного амина содержит две алкильные группы, то основные свойства у этого соединения выражены большей мерой в сравнении с первичным амином.
Ароматический амин анилин, является основанием более слабым чем аммиак и алкиламины. Из-за сопряжения нераздельной электронной пары атома Азота с п-электронами бензольного кольца она частично подвергается делокализации по ароматической системе и становится менее доступной для взаимодействия с катионом H+.
Таким образом, основность соединений уменьшается в ряде:
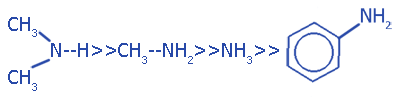
Применение C6H5--NH2
1. Для синтеза многих исходящих.
2. Для производства красителей.
3. Для производства лаков, фотоматериалов.
4. Для производства полимеров, взрывчатых веществ.
Амины. Анилин (часть 1) (часть 2)
Автор: Гончаренко Л. И. (ula-books.com.ua)
< Урок 68 | Химия. Онлайн учебник | Урок 70 >
Смотрите также:
Применение простых веществ Углерода
Алкены. Химические свойства и изомерия
Алкины. Применение ацетилена