Урок 31. Кислород и Озон (O2 и O3). Применение
Химия. Онлайн учебник → Кислород и Озон. Применение
O2 - химическая формула, O=O ковалентная неполярная связь. O2 - газ без цвета, вкуса и запаха, малорастворим в воде. Жидкий кислород имеет голубой цвет, tкип. = -183 °C. Твердый кислород - синие кристаллы, tпл. = -218,7 °C.
Получение в лаборатории
1. Распад бертолетовой соли (хлората калия KClO3):
2KClO3 (t) (MnO2) = 2KCl + 3O2
2. Распад перманганата калия (KMnO4):
2KMnO4 (t) = K2MnO4 + MnO2 + O2
3. Распад H2O2 во время нагревания при наличии катализатора - оксида марганца (IV) MnO2:
2H2O2 (t) (k) = O2 + 2H2O
Химические свойства кислорода
1. Взаимодействует с простыми веществами - с металлами и неметаллами.
Создаются оксиды
| основные | кислотные | амфотерные |
| 4Li + O2 = 2Li2O | S + O2 = SO2 | 2Zn + O2 = 2ZnO |
2. Некоторые сложные вещества вступают в реакцию с кислородом, создавая при этом оксиды:
2CO + O2 = 2CO2
CH4 + 2O2 = CO2 + 2H2O
Степени окисления Кислорода в соединениях
1. CaO(-2), H2O(-2).
2. H2(+1)O2(-1) - водород пероксид.
3. O(+2)F2(-1) - кислород фторид, O2(+1)F2(-1).
Применение O2
1. В медицине.
2. На взрывных роботах.
3. Для сварки металлов.
4. Для резки металлов.
5. В авиации для дыхания.
6. В металлургии.
7. Для интенсификации химических процессов во многих производствах.
Выявление кислорода: тлеющую скалку внести в пробирку с кислородом, она загорится - кислород поддерживает горение.
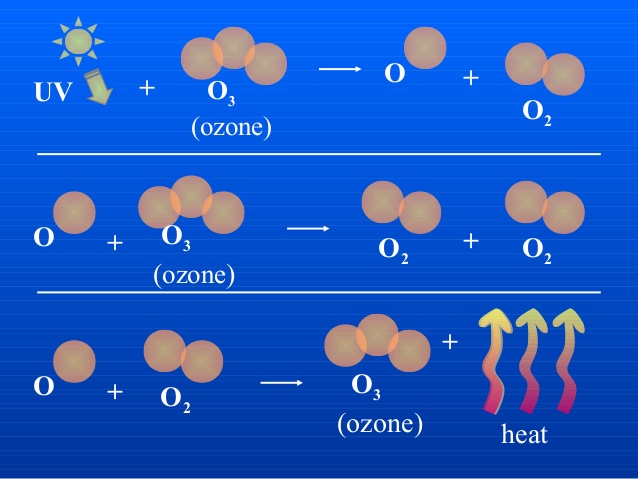
Озон - O3
Это бесцветный сильно токсический газ с резким запахом. Нестойкий, постепенно превращается на кислород: 2O3 = 3O2. Озон - аллотропическая модификация Кислорода.
O2 и O3 созданы одним и тем самым элементом, свойства их разные. O3 разрушает органические вещества, окисляет большинство металлов, в том числе Au и Pt, он более сильный окислитель, чем кислород. Например, из раствора иодида калия он выделяет йод, тем временем как с кислородом эта реакция не происходит.
2KI(-1) + O3(0) + H2O = I2(0) + 2KO(-2)H + O2(0)
2I(-1) - 2e → I2(0) | 1
O3(0) + 2e → O2(0) + O(-2) | 1
Озон имеет отбеливающее и дезинфицирующее действие.
Автор: Гончаренко Л. И. (ula-books.com.ua)
< Урок 30 | Химия. Онлайн учебник | Урок 32 >
Смотрите также:
Теория окислительно-восстановительных реакций
Гомогенные и гетерогенные реакции. Скорость
Урок 14. Способы добывания оснований