Урок 67. Эфиры. Жиры (часть 2)
Химия. Онлайн учебник → Эфиры. Жиры (часть 2)
Химические свойства
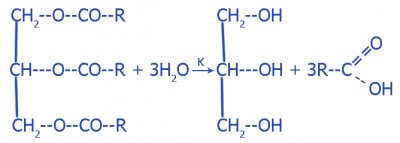
Гидролиз:
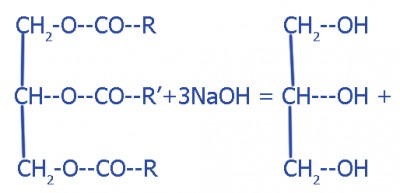
При основном гидролизе создаются соли высших жирных кислот - мыло (реакция омыления):
+ 3RCOONa + 3R'COONa + 3R''COONa
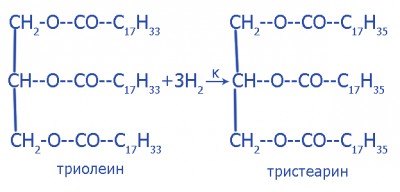
Гидрирование (гидрогенизация):
Окисление
Во время хранения жиров на воздухе происходит частичное окисление. Создаются свободные карбоновые кислоты, а ненасыщенные карбоновые кислоты окисляются с созданием альдегидов и кетонов.
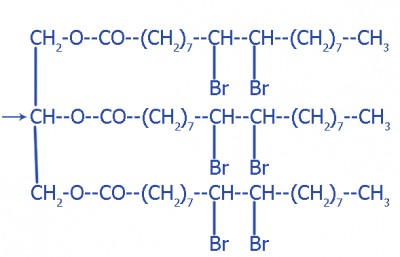
Отображение ненасыщенных жидких жиров через взаимодействие с бромной водой (происходит обесцвечивание реагента):
Применение жиров
1. В пищевой промышленности.
2. В производстве косметических средств.
3. В медицине.
4. В технике.
5. В строительстве.
Мыло
Широкое применение приобрели соли высших жирных кислот - мыло. Натриевые соли - твердые вещества, а калиевые - жидкие.
Производство мыла
C15H31COOH + KOH →C15H31COOK + H2O
C15H31COOH - пальмитиновая кислота
C15H31COOK - пальминат калия
2C17H35COOH + Na2CO3 → 2C17H35COONa + CO2 + H2O
C17H35COOH - стеариновая кислота
Na2CO3 - сода
C17H35COONa - стеарат натрия
Моющее действие мыла - сложный физико-химический процесс. Его суть заключается в отсоединении частиц грязи, например от поверхности ткани, и создании эмульсии или суспензии. В воде мыло растворяется и попадает под частичный гидролиз:
C17H35COONa + H2O ⇔ C17H35COOH + NaOH
Эфиры. Жиры: (часть 1) (часть 2)
Автор: Гончаренко Л. И. (ula-books.com.ua)
< Урок 66 | Химия. Онлайн учебник | Урок 68 >
Смотрите также:
Электронное строение и свойства Железа (Fe)
Сера. Химические свойства и применение
Урок 33. Азот (N2) и соли аммония (NH4)